








Clicando no link a seguir AQUI, você vai acessar um simples applet java que simula um fluido (líquido, gás, sólido, depende da temperatura e pressão que você escolher) composto por discos macios.
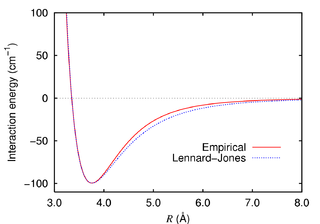
É como se a gente estivesse observando uma caixa contendo partículas atômicas (argônio, xenônio, etc) só que apenas em duas dimensões. Dá para usar esse programinha em uma aula de físico-química para ensinar sobre estados termodinâmicos da matéria apenas variando os valores das variáveis de estado (temperatura, densidade, pressão, número de átomos, etc). <Dr. Chatoff mode on>Apenas a título de informação, essa técnica de modelagem molecular é bem comum no meio acadêmico. Eu mesmo a conheço bem, visto que fiz doutorado em simulação de líquidos por dinâmica molecular. As partículas resumem-se a bolinhas que interagem umas com as outras por meio de potenciais aditivos aos pares, no caso desse applet usa-se o potencial de Lennard-Jones 12-6.![V(r) = 4\epsilon \left[ \left(\frac{\sigma}{r}\right)^{12} - \left(\frac{\sigma}{r}\right)^{6} \right],](http://upload.wikimedia.org/math/3/2/2/322cc39097022640ec80fb402803e4c0.png)
Na equação acima, o parâmetro ε representa toda a parte eletrônica e nuclear do átomo, é chamado de parâmetro energético, polarizabilidade ou simplesmente "profundidade do poço de potencial". O parâmetro σ representa a distância entre dois átomos do mesmo tipo na qual a energia potencial é zero. Representa o tamanho do átomo, tem valores grandes para átomos grandes (xenônio, por exemplo) e valores pequenos para átomos pequenos (hélio, por exemplo).
O parâmetro r representa a distância de separação entre os dois átomos. Se r for muito pequeno, o ramo de energia potencial repulsiva r−12 cresce absurdamente e as partículas tenderão a se repelir, se a distância r tornar-se muito grande, o ramo de energia potencial atrativa r−6 vai assumir maior valor e fazer com que as partículas voltem a se aproximar. Isso ajuda a representar as famosas forças de dispersão, conhecidas na Química como forças de Van der Waals.
Agora, voltando ao applet:


P.S.: Esqueci de colocar o link para o applet, mas agora já está corrigido. Divirtam-se.
Criado em 1976 para promover um espírito de empreendedorismo ao redor do mundo, o Rolex Awards reconhece projetos pioneiros que demonstrem pensamento inovador e contribuem para o aprimoramento da humanidade.
Desde que foi criado, o Rolex Awards já obteve mais de 25800 projetos inscritos e já concedeu 110 prêmios.

Batizado de "pot-in-pot preservation cooling system", esse sistema é também chamado de "refrigerador do deserto" e utiliza um princípio básico da físico-química para conservar frutas e vegetais sem usar nada de energia elétrica.
Consiste de dois potes de barro cozido de diferentes diâmetros, o de diâmetro menor é posicionado dentro do de diâmetro maior e o espaço entre eles é preenchido com areia.
A areia deve ser mantida umedecida permanentemente a fim de que a refrigeração possa ser mantida.
O pote menor é usado para armazenar as frutas e os vegetais e, por sua vez, é coberto com um pano umedecido.

A geladeira do deserto funciona por um processo muito simples, a água contida na areia absorve o calor dos alimentos e o calor do ambiente, ao fazer isso ela evapora. O calor retirado dos alimentos é usado para a mudança de estado físico da água (do líquido para o vapor) e, como consequência, a temperatura no interior da geladeira diminui vários graus.

Experimentos realizados pela University of Benin City com um sistema de refrigeração similar ao do Sr. Mohammed mostraram que é possível obter temperaturas de 14 a 20 graus abaixo da temperatura ambiente.
O interessante do trabalho do Sr. Mohammed não foi a invenção do aparato, mas a forma como ele estimulou a população a adotar seu invento. Inicialmente ele presenteava as pessoas com os potes, em seguida ele passou a cobrar um valor próximo ao custo dos potes de barro, a fim de custear novas unidades para diferentes famílias ainda não atendidas pelo invento. A partir do momento em que a invenção foi amplamente aceita pela população, ele assegurou-se que o processo de produção e distribuição fosse auto-sustentável.
As pessoas atendidas pelo invento puderam guardar seus alimentos não mais por TRÊS DIAS, mas por até TRÊS SEMANAS.
Ele merecidamente ganhou o prêmio de 100.000 doletas, aplicou todo o prêmio na produção de novos potes de barro, empregando população local e gerando renda.
Os potes menores são vendidos por US$ 2,00 e os maiores US$ 4,00; um preço bastante acessível para as populações pobres da Nigéria.
<Dr. Chatoff mode on>
Explicação segundo as leis da termodinâmica:
O calor SEMPRE flui do corpo mais quente para o corpo mais frio, é uma lei natural e é SEMPRE observada. Acontece que o corpo mais quente possui moléculas mais desordenadas e agitadas. As moléculas mais agitadas colidem com as paredes do recipiente com maior frequência, transferindo energia cinética. Essa energia cinética vai lentamente sendo transmitida para as moléculas menos agitadas do recipiente com menor temperatura. Ao longo do tempo, a tendência é que as moléculas dos dois recipientes (o quente e o frio) atinjam a mesma temperatura (mesmo grau de agitação térmica).
Como no caso da geladeira do deserto o sistema é aberto, quando as moléculas de água "roubam" calor das frutas e vegetais elas passam mais facilmente ao estado de vapor e escapam para o ambiente, levando o calor das frutas consigo. Por isso a necessidade de molhar continuamente a areia e o pano.
<Dr. chatoff mode off>
FONTE: MDiG

FONTE: Learn Something Everyday
Decidi escrever alguns posts simples como os primeiros que escrevi para esse blog, pois acredito que nem todo mundo tem paciência de ficar lendo coisas complicadas.
Seguindo essa tendência, resolvi falar sobre uma coisa bem corriqueira e que está presente na casa de todo mundo. O post de hoje é sobre como funciona o sabão. Antes de continuar, que tal vocês darem uma passadinha no link abaixo e clicar com o mouse na janelinha preta que vai aparecer?(Dica: voce vai precisar do Java instalado no seu computador e vai precisar instalar um applet também.) http://www.worldofmolecules.com/3D/soap.htm-------------------------(quem tiver preguica de ler, pode pular essa parte)----------------- Na primeira janela tem uma representação espacial de molécula de sabão. Trata-se de uma estrutura do tipo sal de ácido graxo. Cuméquié? Ácido graxo é o nome técnico para as gorduras animais e vegetais que costumamos ingerir diariamente no toucinho da feijoada, na calabresa da pizza, no óleo de soja que frita o pastel (na verdade é quase isso, mas deixa quieto). Todo ácido graxo tem uma carboxila (ver reação química abaixo), que por reação com soda cáustica aquosa forma um sal.


A micela é como uma bola, a parte exterior está cheia de cabeças e a parte interior está cheia de caudas. As caudas "cravam-se" na gotícula de gordura, solubilizando-a. As cabeças ficam apontadas para o lado de fora, solubilizando toda a estrutura na água de lavagem. (veja a figura abaixo)

 Eu sei que essa dica é mais velha que andar para a frente, mas ainda assim acho que vale a pena postar por aqui.
Eu sei que essa dica é mais velha que andar para a frente, mas ainda assim acho que vale a pena postar por aqui.

 O importante é que em uma questão de minutos você deverá ter a sua bebida geladinha. Passe cada latinha em um balde com água para lavar e não ficar com gosto de sal na boca e bon apetit. NOTAS FINAIS: Tome cuidado para não deixar a mistura muito gelada, pode ser que você acabe com um picolé de cerveja ao invés de uma bebida geladinha.NOTA 2: Se você já se perguntou porque os moradores de países frios jogam sal na calçada, a explicação dada neste post serve para explicar. O sal faz com que o gelo da calçada (deve estar em torno de -15 ou -10 graus Celsius no ambiente) passe do estado sólido ao líquido, facilitando a remoção do mesmo com uma pá. NOTA 3: Mais adiante eu vou postar como fazer sorvete com esse mesmo princípio.
O importante é que em uma questão de minutos você deverá ter a sua bebida geladinha. Passe cada latinha em um balde com água para lavar e não ficar com gosto de sal na boca e bon apetit. NOTAS FINAIS: Tome cuidado para não deixar a mistura muito gelada, pode ser que você acabe com um picolé de cerveja ao invés de uma bebida geladinha.NOTA 2: Se você já se perguntou porque os moradores de países frios jogam sal na calçada, a explicação dada neste post serve para explicar. O sal faz com que o gelo da calçada (deve estar em torno de -15 ou -10 graus Celsius no ambiente) passe do estado sólido ao líquido, facilitando a remoção do mesmo com uma pá. NOTA 3: Mais adiante eu vou postar como fazer sorvete com esse mesmo princípio.