Em um post anterior, eu expliquei como funcionam as bolhas de sabão.
Voltando ao assunto, hoje eu vou explicar o porquê daquelas cores tão bonitas que elas costumam exibir.
Sigam lendo o post.
Cor, um dos aspectos mais belos das bolhas, também fornece uma ferramenta extremamente interessante para a medição da espessura do filme de bolhas.
Ondas luminosas, assim como ondas do mar, possuem picos e vales (cristas e depressões). A luz vermelha tem o maior comprimento de onda e o violeta o menor.
Todas as ondas, incluindo a luz, têm uma propriedade curiosa: se duas ondas se combinam, as ondas podem se encontrar crista com vale, cancelando-se mutuamente;
Quando elas se encontram crista com vale, para cada vibração "para cima" em uma onda, existe uma vibração "para baixo" correspondente na outra onda. Essa combinação de quantidades iguais de "para cima" e "para baixo" causa um completo cancelamento ou interferência.
A interferência é responsável pelo brilho perolado e lustroso de uma casca de abalone, as belas cores em algumas penas de aves e asas de insetos, e manchas flutuantes de cor em uma camada de óleo sobre uma poça de água parada. Isso é verdadeiro também para as bolhas de sabão.
Concha de abalone (haliote)

Asa de um inseto

Água contendo uma fina camada de óleo sobre si
Tem mais explicação na sequência....
#more
A luz branca é formada por todas as cores, todos os comprimentos de onda. Se uma dessas cores é subtraída da luz branca (por interferÊncia, por exemplo) nós vemos a cor complementar. Por exemplo, se a luz azul é subtraída da luz branca, nós enxergamos amarelo. A pele de uma bolha reluz com cores complementares produzidas pela interferência. Se nós tivéssemos que olhar para uma porção ampliada de uma membrana de bolha de sabão, notaríamos que a luz reflete tanto pelo exterior quanto pelo interior da bolha, mas os raios de luz que são emergem do interior da bolha viajam uma distância maior que o raio que são refletidos da parte externa da membrana. Esses raios se recombinam de forma que estão fora de fase (suas cristas e vales não estão em sincronia) e produzem interferências (tanto do tipo construtiva quando do tipo destrutiva). Dada uma certa espessura da membrana da bolha, um certo comprimento de onda será cancelado e sua cor complementar será visualizada. Comprimentos de onda maiores (vermelho) necessitam de uma parede de bolha mais espessa do que os de comprimento de onda mais curtos (violeta). Quando o vermelho é cancelado, ele deixa um reflexo azul-esverdeado.

400 nm Violeta absorvido, Verde-amarelado observado(λ 560 nm)
450 nm Azul absorvido, Amarelo observado (λ 600 nm)
490 nm Azul-esverdeado absorvido, Vermelho observado (λ 620 nm)
570 nm Amarelo-esverdeado absorvido, Violeta observado (λ 410 nm)
580 nm Amarelo absorvido, Azul-escuro observado (λ 430 nm)
600 nm Laranja absorvido, Azul observado (λ 450 nm)
650 nm Vermelho absorvido, Verde observado (λ 520 nm)
A "pele" de uma bolha reluz com as cores complementares produzidas pela interferência. Se nós olhássemos para uma porção extremamente ampliada da membrana de uma bolha de sabão, nós poderíamos notar que a luz é refletida tanto da parte externa quanto da parte interna dessa membrana, mas o raio de luz que é refletido a partir da superfície interna viaja uma distância maior que o raio refletido a partir da superfície externa da membrana.
Quando os dois raios se recombinam eles podem ficar "fora de fase" um com o outro e produzir uma nova interferência. Dada uma certa espessura de membrana, um determinado comprimento de onda será cancelado e sua cor complementar será vista por nossos olhos.
Comprimentos de onda longos (vermelho) necessitam de uma bolha com paredes espessas para que esse "fora de fase" aconteça. Já para que comprimentos de onda curtos (violeta) possam sofrer esse fenômeno, é necessário uma espessura menor de membrana.
Quando o vermelho é cancelado, ele deixa um reflexo azul-esverdeado. À medida que a bolha afina, o amarelo é cancelado, deixando a cor azul surgir; então o verde é cancelado, surgindo a cor magenta; e finalmente o azul é cancelado, deixando o amarelo aparecer.
Eventualmente a bolha torna-se tão fina que o cancelamento ocorre para todos os comprimentos de onda e a bolha parece ter uma cor negra contra um fundo negro.
Este surpreendente cancelamento completo é devido à forma diferente com que a luz reflete-se das duas superfícies. Quando a luz é refletida a partir da superfície externa da bolha (uma interface ar-água) a direção de vibração da onda é revertida - todas as vibrações "para cima" são tornadas "para baixo" e vice-versa.
(Algo similar acontece quando você vibra uma corda afixada em uma parede; o pulso refletido de cabeça para baixo após bater na parede.)
Quando a luz é refletida vindo da superfície interna da bolha (interface água-ar) a direção da vibração não é alterada. Se a membrana da bolha for muito fina, muito menor que o comprimento de onda da luz visível, então os dois raios de luz refletidos sempre se encontrarão crista-com-vale e uma interferência destrutiva é produzida.
Não acontecerá uma reflexão visível, e a bolha parecerá negra. Quando você vir isso acontecendo na superfície de uma bolha de sabão você saberá que a bolha tem uma espessura de apenas pouco mais de UM MILIONÉSIMO DE UMA POLEGADA e irá estourar em breve.
A luz branca é separada em cores básicas quando refletida a partir de duas superfícies de um filme fino. Quando as duas reflexões interferem construtivamente, elas produzem uma banda de cor. Quando elas intereferem destrutivamente, elas se cancelam mutuamente e aquela cor é subtraída do espectro.

As bandas alternantes de luz e escuridão sobre o filme de sabão são na verdade bandas de cor, produzidas por reflexão e interferência das ondas de luz. As cores dependem da espessura do filme. O filme exibido aqui ao lado está mais fino no topo, tornando-se mais espesso no fundo. Quando a espessura do filme muda, as cores também mudam, formando bandas regulares.

FONTE
Estava lendo o OMEDI ontem e vi esses dois belos vídeos:
Daí, pensei comigo: "por quê não escrever sobre como funcionam as bolhas de sabão?"
Os átomos de hidrogênio têm um único elétron que tende a gastar muito de seu tempo "dentro" da molécula de água, em direção ao átomo de oxigênio, deixando sua eletrosfera "nua", ou com carga parcialmente positiva. O átomo de oxigênio tem oito elétrons e, frequentemente, a maioria deles está em torno do átomo de oxigênio, fazendo com que a molécula seja carregada negativamente nessa região.
Uma vez que cargas opostas se atraem, não é nenhuma surpresa que os átomos de hidrogênio de uma molécula de água gostam de apontar para os átomos de oxigênio de outras moléculas. É claro que no estado líquido, as moléculas têm muita energia para assumir um padrão fixo, no entanto, as inúmeras "pontes de hidrogênio" temporárias entre as moléculas tornam a água um fluido extraordinariamente "pegajoso".

Dentro da água, a algumas moléculas de distância da superfície, cada molécula está envolvida em um "cabo-de-guerra" com seus vizinhos por todos os lados. Para cada puxada "para cima" existe uma puxada "para baixo", e para cada puxada "para a esquerda" existe um empurrão "para a direita", e assim por diante, de forma que uma dada molécula não sente nenhuma força líquida no processo. Na superfície as coisas são diferentes. Não há um "puxar para baixo" para cada "puxar para cima", desde que, naturalmente, não há líquido acima da superfície, assim as moléculas da superfície tendem a ser puxadas de volta para o interior do líquido. É preciso gastar trabalho para puxar uma molécula até a superfície. Se a superfície é esticada - como quando você sopra uma bolha de sabão - torna-se maior em área, e mais moléculas são arrastados de dentro do líquido para tornar-se parte dessa área maior. Este efeito de "pele elástica" é chamado de tensão superficial. A tensão superficial desempenha um papel importante na forma como se comportam os líquidos. Se você encher um copo com água, você será capaz de adicionar a água acima da borda do copo, simplesmente porque a tensão superficial existe.
| Você pode fazer um clipe flutuar na superfície de um copo de água. Antes de tentar isso, você deve saber que fica mais fácil se o clipe de papel estiver um pouco gorduroso de tal forma que a água não consegue molhá-lo (esfregue-o no nariz ou na testa antes de colocar na água.). Coloque o clipe de papel em um garfo e abaixe-o lentamente na água. O clipe é sustentado pela "película" formada pela tensão superficial da água. |  |
 |
O caminhante das águas é um inseto que caça suas presas na superfície da água parada, ele tem pés amplamente espaçados ao estilo dos "pés" de um módulo espacial de "aterrisagem" lunar. A "película" superficial de água sofre uma depressão sob os pés do inseto mas não "arrebenta" porque ele é leve. |
Ao contrário de uma bola de borracha que, quando não esticada perde toda a tensão, uma bolha sempre tem tensão presente, não importa quão pequena a superfície se torne.
Se você explodir uma bolha e fechar a abertura tapando a entrada de ar do canudo, a tensão na "pele" da bolha tenta reduzir a bolha em uma forma com a menor área de superfície possível para o volume de ar que ele contém. Essa forma passa a ser uma esfera.
 |
Forma |
# of sides | Volume | Área Superficial |
| Tetraedro | 4 | 1 pol cub | 7.21 pol quad | |
| Cubo | 6 | 1 pol cub | 6 pol quad | |
| Octaedro | 8 | 1 pol cub | 5.72 pol quad | |
| Dodecaedro | 12 | 1 pol cub | 5.32 pol quad | |
| Icosaedro | 20 | 1 pol cub | 5.15 pol quad | |
| Esfera | infinitos | 1 pol cub | 4.84 pol quad |
Alguma vez você já tentou fazer uma bolha com água pura? Não funciona, né?.
Há um equívoco comum de que a água não tem a tensão superficial necessária para manter uma bolha de sabão e de que o sabão aumenta essa tensão, mas de fato o sabão diminui a força da tensão superficial - normalmente a cerca de um terço da tensão da água.
A tensão superficial da água pura é muito forte para que as bolhas durem algum tempo. Um outro problema com bolhas de água pura é a evaporação: a superfície rapidamente torna-se fina, causando o "estouro" das bolhas. O máximo que podemos observar na água é a formação de "espuma", composta por microbolhas de água (e mesmo essa é de curta duração).
| As moléculas de sabão são compostas por longas cadeias de átomos de carbono e hidrogênio. Em um extremo da cadeia há uma configuração de átomos que gostam de estar na água (hidrofílicas). A outra extremidade evita a água (hidrofóbicas), mas atrai-se facilmente pela gordura. Na lavagem, a terminação "gordurosa" da molécula de sabão se liga à gordura no seu prato sujo, deixando escoar a água em baixo. A partícula de gordura é removida e rodeada por moléculas de sabão, o qual é levado por uma enxurrada de água. (Leia mais sobre sabões nesse meus POST anterior.) |  |
Em uma solução de sabão e água a extremidade hidrofóbica (gordurosa) da molécula de sabão não quer estar no líquido. Aquelas que encontram o caminho para a superfície forçam sua passagem por entre as moléculas de água da superfície, empurrando suas extremidades hidrofóbicas para fora da água.
Isso separa as moléculas de água umas das outras.
Como as forças de tensão superficial tornam-se menores à medida que a distância entre as moléculas de água aumenta, as moléculas de sabão diminuem a tensão superficial.
Se um copo mais cheio de água mencionado anteriormente for levemente tocado com um dedo contendo um pouco de sabão, a pilha de água imediatamente derrama-se sobre a borda do copo, a
"pele" de tensão superficial não é mais capaz de suportar o peso da água porque as moléculas de sabão separaram as moléculas de água, diminuindo a força de atração entre elas.
|
Porque a extremidade gordurosa da molécula de sabão sai da superfície da bolha, o filme de sabão é pouco protegido da evaporação (gordura não evapora na temperatura ambiente), o que prolonga a vida da bolha substancialmente. Um recipiente fechado saturado com vapor de água, também diminui a evaporação e permite que os filmes de sabão durem ainda mais. |
 |



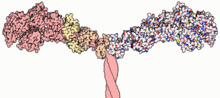
A actina tem quatro principais funções nas células:
- Formar microfilamento que dão suporte mecânico às células e prover suporte à trasmissão de sinais elétricos aos arredores.
- Permitir mobilidade celular.
- Em células musculares, ser uma espécie de esqueleto para a miosina, a qual gera força para suportar a contração muscular.
- Eis uma representação em fita da actina.






Resolvi tirar a preguiça do corpo e escrever um pouco mais sobre as descobertas que fundamentaram a ciência moderna.
Claro que eu vou continuar falando sem grandes pretensões, a minha ideia é informar sem esquecer o aspecto lúdico que a ciência pode ter. E, sempre que possível, vou lançar mão de recursos online para fazer isso.
O último post que escrevi fazia uma indagação: "Átomos são como pudins?"
Pelo menos foi a conclusão a que chegou o Sr. Thomson.
Agora, vamos conversar um pouco mais sobre os desenvolvimentos que levaram os cientistas ao modelo planetário.
Mais especificamente, vamos tratar da descoberta de Sir Ernest Rutherford e das implicações das teorias de Aage Niels Bohr no modelo atômico.


Rutherford realizou um experimento, hoje considerado clássico, no qual uma folha muito fina de ouro (tinha aproximadamente 100 átomos de espessura) era bombardeada com partículas alfa.
As partículas alfa são compostas por dois prótons e dois nêutrons, igual ao núcleo do elemento químico hélio só que sem os elétrons.
As partículas alfa são pesadas para os padrões atômicos, e ainda por cima possuem carga positiva igual a 2+.
Se as partículas alfa encontrarem prótons no seu caminho, que também possuem carga positiva, a repulsão eletrostática será tão grande que ela sofrerá um desvio na trajetória.
Foi o que Rutherford esperava observar, um grande número de partículas alfa desviando sua trajetória ao colidir com os átomos de ouro da folha que ele preparou.
Uma representação esquemática do aparato preparado por Rutherford pode ser vista na figura abaixo:

A tela de detecção era sensibilizada com uma substância que brilhava a cada partícula alfa que a atingisse. Dizem que Rutherford colocou um aluno a observar a tal tela, ele tinha que contabilizar cada brilho que aparecesse nela.
Mais tarde, o tal aluno ficaria famoso por inventar um equipamento de detecção de radiação nuclear conhecido pelo nome de "contador Geiger".
O problema é que o átomo não era como Thomson havia proposto, ele não era composto de uma massa sólida de carga positiva com pequenas cargas negativas incrustadas na massa.
Isso porque, ao invés do que Rutherford observar a maior parte das partículas alfa sofrendo desvio, ele observou que a maioria delas passava direto pela folha de ouro.

Nas palavras dele: "(...) era como se bombardeássemos uma folha de papel com uma bala de canhão e a bala ricocheteasse na folha (...)".
Para que isso acontecesse, era necessário que o átomo fosse beeeem ao contrário do pudim de passas do Thomsom.
A maior parte da massa, de carga positiva, deveria estar concentrada em uma parte bem pequena e central dele. Rutherford chamou-a de núcleo.
A maior parte do volume do átomo deveria estar bem afastada do núcleo, ela deveria conter os elétrons. Rutherford chamou-a de eletrosfera.
O número de cargas positivas de um átomo eletricamente neutro deveria se igualar ao número de cargas negativas.
Estava estabelecido o modelo vigente de átomo, pelo menos a base dele.
E o Bohr, onde entra nessa história?

O modelo foi proposto por ele em 1913.
Basicamente, ele fez algumas suposições físico-matemáticas acerca dos elétrons em um átomo de hidrogênio:
Esse artigo da Wikipedia fala melhor sobre essa parte, sobre a qual falarei em um post futuro.
Para que um elétron pudesse girar em torno do núcleo atômico, ele deveria permanecer energeticamente estável. As leis da física vigentes na época previam que o elétron circulante deveria perder energia até colidir com o núcleo.
Bohr sugeriu as "órbitas estacionárias", nas quais os elétrons podiam permanecer indefinidamente.
Para subir a um nível mais energético, mais distante do núcleo, o elétron deveria receber um quantum energia.
Ao voltar ao nível menos energético, mais próximo do núcleo, o elétron deveria perder um quantum energia.
Assim, estavam estabelecidos os níveis ou camadas energéticas de um átomo, ou eletrosfera.
O modelo combinado é conhecido pelo nome dos dois cientistas: Rutherford-Bohr.
Devido ao fato de prever elétrons girando ao redor de um núcleo, a comparação com o sistema solar é inevitável e o modelo também é conhecido como "modelo planetário".
As equações matemáticas desenvolvidas por Bohr reproduziam exatamente o espectro de raias do Hidrogênio, tal como a equação de Rydberg o fazia.
O sucesso do modelo de Bohr em reproduzir dados experimentais fez com que a representação mais comum do átomo seja usada até hoje, embora esteja incorreta segundo as teorias quânticas mais modernas.

Por hoje era isso, tomara que me sobre um tempo nos próximos meses para continuar com essa série de posts. :)
FONTES: Royal Society of Chemistry, Wikipedia
Hoje é o dia da Terra, ou Earth Day para os íntimos.

Lá no site http://www.earthday.org/ você pode acompanhar toda a movimentação mundial em prol do planeta em todos os lugares em que vai acontecer alguma atividade pública,
E já que o tema de hoje é esse, vamos puxar a brasa para o meu assado que é a físico-química.
Li um artigo bem interessante nesse site aqui ó LINK. O autor fala sobre o fenômeno da tensão superficial. E o que isso tem a ver com o dia da Terra?
Acompanhem o raciocínio comigo:

Moléculas no interior do líquido (água, no caso) apresentam isotropia (ou quase isso) de forças. Em palavras de seres humanos normais, as forças de atração intermoleculares são igualmente distribuídas pelo espaço.
Já as moléculas na superfície do líquido conseguem interagir apenas com moléculas ao lado e abaixo de si, porém interagem muito pouco com outras moléculas acima de si, visto que são raras as moléculas presentes na fase gasosa.
Se você observar bem a figura acima, notará que ocorre um desequilíbrio de forças nas moléculas da superfície, fazendo com que a força resultante seja direcionada para o interior do líquido.

O resultado disso? Forma-se um filme superficial de liquido, uma película. Ela é bem forte, pode suportar o peso de um pequeno inseto sobre ela, às vezes até mesmo um clip de papel pode ser colocado com cuidado sobre o filme superficial sem que ele se rompa.
A tensão superficial é responsável pelos líquidos formarem gotas esféricas, o que determina se o líquido vai ou não molhar uma superfície tem relação também com a tensão superficial. A água, por exemplo, vai espalhar-se bem em superfícies polares, e vai tender a formar gotículas quase-esféricas em superfícies apolares.
A adição de um surfactante (vamos dizer, por exemplo, um detergente líquido) à água faz com que o filme superficial perca coesão. Como resultado disso, a água torna-se mais "molhada", ela se espalha mais do que sem a presença do detergente.
Isso é bem útil quando queremos que a água dissolva uma superfície gordurosa (como aquelas que ficam sobre os pratos que usamos em nossa alimentação). O detergente dissolve a gordura do prato e a água ajuda a carregar a sujeira removida pelo detergente.
Justamente essa tecnologia que nos ajuda a manter nossos utensílios de alimentação limpos é a causa de muita preocupação por parte das pessoas preocupadas com o ambiente terrestre.
O uso indiscriminado de detergentes semi-biodegradáveis faz com que a tensão superficial das águas diminua consideravelmente.
O despejo de nossos resíduos domésticos nos rios e lagos faz com que a água não seja mais um ambiente propício aos pequenos insetos, visto que eles não conseguem mais caminhar sobre o filme superficial com tanta facilidade.
Isso faz com que a reprodução desses pequenos seres seja ameaçada, gerando um desequilíbrio ecológico sem precedentes.
Além disso, certas substâncias presentes nas embalagens plásticas são despejadas nos mesmos rios e lagos e afetam negativamente os ciclos hormonais de pequenos anfíbios e mamíferos que bebem ou vivem nessas águas contaminadas.
Vejam, não quero alarmar ninguém com essa reflexão, mas no dia dedicado ao nosso planeta, nada melhor do que falar abertamente de um problema que certamente não vai parar de cresces enquanto continuarmos a usar indiscriminadamente produtos de limpeza pouco ecológicos.
Uma solução paliativa seria passar a usar o sabão em barra para lavar as louças, ele é menos efetivo que o detergente líquido mas é completamente biodegradável e afetaria em menor escala as águas.
Bom, vou parar de filosofar por aqui, desejo um dia de profundas reflexões a todos os terrestres (e se tiver algum leitor marciano que acessa o blog também sugiro que leia o texto todo e use nas suas salas de aula marcianas).
Abraços digitais!
GAUTO, Marcelo;
; acessado dia 13/04/2010.