Hipoclorito de sódio é um composto salino cuja fórmula mínima é NaClO.
O principal uso do hipoclorito de sódio é como desinfetante/alvejante, aparece como ingreditente principal das águas sanitárias.
Aqui no RS, uma das marcas mais icônicas de água sanitária é a Qboa. (Não, eu não ganhei nada de $$$ para fazer divulgação desse produto.)
O que são alvejantes?
Eles são uma mistura de produtos químicos, sendo que o principal constituinte é uma solução de hipoclorito de sódio (NaOCl) cuja concentração varia de 3 a 6% (massa/volume = 3-6 g de NaOCl por 100 mL de solução aquosa).
Muitas vezes, pequenas quantidades de hidróxido de sódio (NaOH - a famosa soda cáustica), peróxido de hidrogênio (H2O2 - água oxigenada) e hipoclorito de cálcio [Ca(ClO)2].
Os alvejantes são usados para descolorir roupas ou tecidos, branquear ou desinfetar roupas e superfícies, e é um dos produtos mais utilizados na limpeza de cozinhas e banheiros.
Na agricultura o hipoclorito de sódio é usado amplamente.
A indústria química, de tintas, de cal, de alimentos, de vidro, de papel, farmacêutica, de produtos sintéticos e de tratamento de resíduos também utilizam em grande escala esse produto.
No caso do tratamento de resíduos, o hipoclorito de sódio é adicionado com o fim de reduzir odores, desde que o NaOCl neutraliza o gás sulfídrico (H2S - cheiro de ovo podre) e a amônia (NH3 - cheiro de peixe).
Também é utilizado para desentoxicar banhos de cianeto usados no processo de galvanização, e para prevenir o crescimento de algas e cracas em torres de refrigeração.
Em piscinas e reservatórios de água, serve para purificar e manter limpos os estoques desse precioso líquido.
Quem inventou os alvejantes?
Em 1785, o francês Claude Louis Bertholet lançou o primeiro alvejante baseado em hipoclorito de sódio.
O produto, batizado de "liqueur de javel" (licor de alvejante), foi utilizado inicialmente para branquear algodão, mas logo começou a se popularizar e aser usado para branquear outras fibras naturais e também para remover manchas de roupas.
Na Fraça, hipoclorito de sódio ainda é conhecido por "eau de Javel" (água de alvejante).
Qual a aparência do hipoclorito de sódio?
É um pó branco que dissolve bem em água e rende uma solução de cor amarelado com odor característico.
Diferentes concentrações de hipoclorito de sódio apresentam diferentes potenciais em termos de efeito alvejante.
Para uso doméstico, o alvejante costuma conter 5% de hipoclorito de sódio, o pH (índice que indica a acidez de soluções) da água sanitária fica em torno de 11 (básico).
Além disso, o contato com a pele pode provocar irritações.
Alvejante concentrado (10-15% de hipoclorito de sódio) é altamente alcalino (básico, pH em torno de 13) e é tão corrosivo que pode queimar a pele ao mais simples contato.
Como ele é produzido?
O processo original desenvolvido por Bertholet envolvia passar gás cloro (Cl2) através de uma solução de carbonato de sódio (Na2CO3), mas a solução resultante de hipoclorito de sódio era muito fraca. De fato, a adição de gás cloro à água rende tanto ácido clorídrico (HCl) quanto ácido hipocloroso ((HClO).
Cl2 + H2O 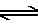 HOCl + HCl(aq)
HOCl + HCl(aq)
Adição de sal a esta mistura permite a formação de uma solução aquosa de hipoclorito de sódio.
Do equilíbrio abaixo, você pode ver que a adição de ácidos a essa solução levará à reação à produção de gás cloro (à esquerda na reação abaixo).
Cl2 + 2 NaOH 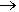 NaCl + NaOCl + H2O
NaCl + NaOCl + H2O
Assim, para que a reação prossiga no sentido direto (produção de hipoclorito) é necessário adicionar álcalis (bases), tais como o NaOH.
Um método de produção mais efetivo foi inventado na década de 1890 por E.S. Smith e envolvia eletrolisar uma solução salina para produzir NaOH e gás cloro, os quais eram misturados para formar o hipoclorito.
Nos dias atuais, o único método de escala industrial usado para a produção de hipoclorito é chamado de processo Hooker, e é apenas uma versão melhorada do processo de Smith.
Neste, o gás cloro (Cl2) é passado por uma solução resfriada de NaOH (hidróxido de sódio), formando o hipoclorito de sódio (NaOCl), com cloreto de sódio (NaCl - sal comum) como principal subproduto.
A reação de desproporcionamento (O Cl2 é simultaneamente oxidado e reduzido) é completada através de eletrólise, e a mistura deve ser mantida abaixo de 40ºC para prevenir a formação indesejada de clorato de sódio (NaClO3).
Cl2 + 2 NaOH 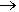 NaCl + NaOCl + H2O
NaCl + NaOCl + H2O
Como o alvejante funciona?
O hipoclorito de sódio é altamente reativo, e também é muito instável.
Se deixado exposto à atmosfera, o gás cloro "evapora" da solução a uma taxa considerável, e se for aquecido o hipoclorito de sódio produz sal comum e oxigênio. Isso também acontece quando ele entra em contato com ácidos, luz solar, certos metais, muitos gases, e é uma das razões pelas quais a água sanitária pode ser usada em larga escala - após o uso ela se decompõe em produtos benignos (sal e água) os quais podem ser despejados no sistema de esgotos sem problemas.
O alvejante funciona de diversas maneiras. O ácido hipocloroso (HClO) é um agente oxidante muito forte (até mais forte que o gás cloro - Cl2), e pode reagir com e destruir muitos tipos de moléculas, incluíndo os corantes orgânicos presentes nas roupas.
Também o íon hipoclorito se decompõem em cloreto (Cl-) e em uma forma muito reativa de oxigênio:
2ClO- 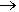 2Cl- + O2
2Cl- + O2
O HClO (e em menor extensão o Cl2 e o oxigênio ativo) podem então ativar as ligações químicas de um composto colorido (e eles costumam possuir muitas ligações duplas conjugadas prontinhas para sofrer ataque químico), ou destruir os grupos cromóforos (a parte da molécula que confere cor ao composto por doação ou remoção de densidade eletrônica), ou convertendo as ligações duplas nos cromóforos em ligações simples, fazendo com que a molécula perca a capacidade de absorver luz visível.
Quando ele reage com micróbios, o hipoclorito de sódio ataca as proteínas das células causando a agregação destas e dos micróbios e fazendo com que eles morram.
Ele também pode causar a "queima" das membranas celulares. Esse ataque de amplo espectro faz com que o alvejante seja efetivo contra uma enorme gama de bactérias.
O hipoclorito de sódio é alcalino, e a água sanitária também contém NaOH para fazer a solução ficar ainda mais alcalina.
Duas substâncias são formadas quando o hipoclorito de sódio se dissolve em água: Elas são o ácido hipocloroso (HClO) e o íon hipoclorito (OCl-), a proporção das duas substâncias é determinada pelo pH da solução.
Efeitos colaterais perigosos
Se você manusear água sanitária ou outra solução de hipoclorito de sódio com respeito e segurança, estará agindo de maneira correta e evitando acidentes.
Em 2002 foi feita uma estimativa do número de acidentes com essa substância no Reino Unido. Ocorreram cerca de 3300 sinistros que envolveram internações e tratamentos hospitalares.
Muitos desses acidentes envolveram a ingestão do líquido, geralmente crianças desavidas ou não supervisionadas por um adulto.
Como a água sanitária caseira contém soda cáustica, o contato com a pele pode provocar queimaduras de pele, destruição de tecidos e de gorduras corporais.
A liberação lenta de gás cloro também contribui para a irritação dos brônquios pulmonares.
No Brasil, caso você necessite de algum auxílio especializado com este tipo de produto (ou qualquer outro tóxico), ligue para o Centro de Informações Toxicológicas (CIT).
Ao final do post eu publico os números de telefone em cada capital do país.
A mistura de água sanitária com outros produtos caseiros pode ser fatal devido a reações paralelas.
Por exemplo, se ácido for adicionado à água sanitária, como mencionado antes, haverá a produção de gás cloro (irritação das mucosas e dos brônquios).
A mistura com soluções de limpeza baseadas em amônia (Ajax e outros ou aé mesmo urina) pode produzir cloroaminas, as quais são tóxicas:
NH3 + NaOCl 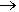 NaOH + NH2Cl
NaOH + NH2Cl
NH2Cl + NaOCl 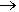 NaOH + NHCl2
NaOH + NHCl2
NHCl2 + NaOCl 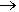 NaOH + NCl3
NaOH + NCl3
Outra reação possível com alguns produtos caseiros, tais como surfactantes e fragrâncias produz compostos orgânicos voláteis clorados (VOCs), tais como o tetracloreto de carbono (CCl4) e o clorofórmio (CHCl3), os quais podem ser danosos à saúde.
No entanto, o benefício gerado pela limpeza e desinfecção dos cômodos da sua casa provavelmente valem o risco corrido pela presença dessas substâncias na área de serviço (principalmente o risco de formação de VOCs).
A água sanitária pode reagir violentamente com peróxido de hidrogênio para produzir gás oxigênio O2::
H2O2(aq) + NaOCl(aq) 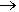 NaCl(aq) + H2O(l) + O2(g)
NaCl(aq) + H2O(l) + O2(g)
No Brasil, se você necessitar de auxílio técnico para a manipulação de substâncias potencialmente tóxicas ou letais, contate o CIT da sua região através dos contatos abaixo:
Centros para buscar atendimento nas capitais
Região Sudeste
Belo Horizonte
Serviço de Toxicologia de Minas Gerais Endereço: avenida Professor Alfredo Balena, 400 - 1º andar - Santa EfigêniaHospital João XXIIITelefone: (31) 3224-4000 / (31) 3239-9308 / 3239-9224 / 0800-722-6001
São Paulo
Centro de Assistência Toxicológica - Instituto da Criança da Faculdade de Medicina da Universidade de São PauloEndereço: Hospital das Clínicasavenida Dr. Enéas de Carvalho Aguiar, 647 - 3º andar - Instituto da Criança - PinheirosTelefone: (11) 3069-8571 / 3088-7645 / 0800-148-110
Vitória
Centro de Atendimento Toxicológico do Espírito Santo - TOXCENEndereço: Hospital Infantil Nossa Senhora da GlóriaAlameda Mary Ubirajara, 205 - Santa LúciaTelefone: (27) 3137-2400 / 3137-2406 / 0800-283-9904
Região Sul
Curitiba
Centro de Controle de Envenenamentos de CuritibaSupervisora: Drª Marlene EntresEndereço: Hospital de Clínicas da UFPRRua General Carneiro, 180Telefone: (41) 3264-8290 / 3363-7820 / 0800-410-148
Florianópolis
Centro de Informações Toxicológicas de Santa CatarinaEndereço: Universidade Federal de Santa Catarina - Hospital Universitário - Bairro TrindadeTelefone: (48) 3721-9535 / 3721-9173 / 3331-9083 / 3331-9173 / 3331-9535 / 0800-643-5252
Porto Alegre
Centro de Informação Toxicológica do Rio Grande do SulEndereço: Rua Domingos Crescêncio, 132 - 8º andar - SantanaTelefone: (51) 2139-9200 até o 9299 / 0800-721-3000
Região Norte
Belém
Centro de Informações Toxicológicas de BelémEndereço: Hospital Universitário João de Barros BarretoRua dos Mundurucus, 4487 - GuamáTelefone: 0800-722601 / (91) 3249-6370 / 3259-3748
Manaus
Centro de Informações Toxicológicas do AmazonasEndereço: Hospital Universitário Getúlio Vargasavenida Apurinã, 4 - Praça 14Telefone: (92) 3622-1972 / 3621-6502 / 3621-6500 / 0800-722-6001
Região Nordeste
Aracaju
Centro de Informação e Assistência Toxicológica de SergipeEndereço: avenida Tancredo Neves, s/nº - Hospital Governador João Alves Filho - CapuchoTelefone: (79) 3259-3645 / PABX do Hospital (79) 3216-2600 Ramal 2677
Fortaleza
Centro de Assistência Toxicológica de FortalezaEndereço: Instituto Dr. José FrotaRua Barão do Rio Branco, 1816 - CentroTelefone: (85) 3255-5050 / 3255-5012
João Pessoa
Centro de Assistência Toxicológica da ParaíbaEndereço: Hospital Universitário Lauro WanderleyCidade Universitária - Campus ITelefone: (83) 3216-7007 / 3224-6688 / 3262-0555 / 0800-722-6001
Recife
Centro de Assistência Toxicológica de PernambucoEndereço: Hospital da Restauração - 1º andarAvenida Agamenon Magalhães, s/nº - DerbyTelefone: (81) 3181-5458 / 3181-5400
Salvador
Centro de Informação Anti-Veneno da BahiaEndereço: Hospital Geral Roberto SantosRua do Saboeiro, s/nº - CabulaTelefone: (71) 3387-4343 / 3387-3414 (diretoria) / 0800 284-4343
Teresina
Centro de Informações Toxicológicas (Citox)Endereço: Rua 19 de novembro, 1865 - Bairro PrimaveraTelefone: (86) 3221-9608 / 3216-3660 / 3216-3662 / 0800-280-3661 (Vig. Sanitária)
Região Centro-Oeste
Brasília
Centro de Informação e Assistência Toxicológica do Distrito FederalEndereço: LACEN-DF - SGAN - nº 601 Norte Telefone: (61) 3225-6512 / 3325-6773/ 0800 644-6774
Campo Grande
Centro Integrado de Vigilância Toxicológica de Mato Grosso do SulEndereço: Hospital Regional do Mato Grosso do SulAvenida Engenheiro Luthero Lopes, 36 - Bairro Aero RanchoTelefone: (67) 3386-8655 / 3378-2558 / 3318-1670 / 0800-722-6001
Cuiabá
Centro de Informação Anti-Veneno de CuiabáEndereço: Hospital Municipal e Pronto Socorro de CuiabáAvenida General Vale, 192 - Bairro BandeirantesTelefone: (65) 3051-9454 / 3051-9450 / 3617-1374 / 0800- 722-6001
Goiânia
Centro de Informações Tóxico-Farmacológicas de GoiásEndereço: Superintendência de Vigilância SanitáriaAvenida Anhanguera, 5195 - Setor CoimbraTelefone: (62) 3291-4350 / 3201-4110 / 3201-4111/ 0800-646-4350
FONTE
















