


Curiosidade:

taxonomia da planta:
aspectos químicos:
fórmula química:
fórmula estrutural plana:







Hipoclorito de sódio é um composto salino cuja fórmula mínima é NaClO.
O principal uso do hipoclorito de sódio é como desinfetante/alvejante, aparece como ingreditente principal das águas sanitárias.

Aqui no RS, uma das marcas mais icônicas de água sanitária é a Qboa. (Não, eu não ganhei nada de $$$ para fazer divulgação desse produto.)

O que são alvejantes?
Eles são uma mistura de produtos químicos, sendo que o principal constituinte é uma solução de hipoclorito de sódio (NaOCl) cuja concentração varia de 3 a 6% (massa/volume = 3-6 g de NaOCl por 100 mL de solução aquosa).
Muitas vezes, pequenas quantidades de hidróxido de sódio (NaOH - a famosa soda cáustica), peróxido de hidrogênio (H2O2 - água oxigenada) e hipoclorito de cálcio [Ca(ClO)2].
Os alvejantes são usados para descolorir roupas ou tecidos, branquear ou desinfetar roupas e superfícies, e é um dos produtos mais utilizados na limpeza de cozinhas e banheiros.
Na agricultura o hipoclorito de sódio é usado amplamente.
A indústria química, de tintas, de cal, de alimentos, de vidro, de papel, farmacêutica, de produtos sintéticos e de tratamento de resíduos também utilizam em grande escala esse produto.
No caso do tratamento de resíduos, o hipoclorito de sódio é adicionado com o fim de reduzir odores, desde que o NaOCl neutraliza o gás sulfídrico (H2S - cheiro de ovo podre) e a amônia (NH3 - cheiro de peixe).
Também é utilizado para desentoxicar banhos de cianeto usados no processo de galvanização, e para prevenir o crescimento de algas e cracas em torres de refrigeração.
Em piscinas e reservatórios de água, serve para purificar e manter limpos os estoques desse precioso líquido.

Quem inventou os alvejantes?
Em 1785, o francês Claude Louis Bertholet lançou o primeiro alvejante baseado em hipoclorito de sódio.

O produto, batizado de "liqueur de javel" (licor de alvejante), foi utilizado inicialmente para branquear algodão, mas logo começou a se popularizar e aser usado para branquear outras fibras naturais e também para remover manchas de roupas.
Na Fraça, hipoclorito de sódio ainda é conhecido por "eau de Javel" (água de alvejante).

Qual a aparência do hipoclorito de sódio?
É um pó branco que dissolve bem em água e rende uma solução de cor amarelado com odor característico.

Diferentes concentrações de hipoclorito de sódio apresentam diferentes potenciais em termos de efeito alvejante.
Para uso doméstico, o alvejante costuma conter 5% de hipoclorito de sódio, o pH (índice que indica a acidez de soluções) da água sanitária fica em torno de 11 (básico).
Além disso, o contato com a pele pode provocar irritações.
Alvejante concentrado (10-15% de hipoclorito de sódio) é altamente alcalino (básico, pH em torno de 13) e é tão corrosivo que pode queimar a pele ao mais simples contato.
Como ele é produzido?
O processo original desenvolvido por Bertholet envolvia passar gás cloro (Cl2) através de uma solução de carbonato de sódio (Na2CO3), mas a solução resultante de hipoclorito de sódio era muito fraca. De fato, a adição de gás cloro à água rende tanto ácido clorídrico (HCl) quanto ácido hipocloroso ((HClO).
Cl2 + H2O ![]() HOCl + HCl(aq)
HOCl + HCl(aq)
Adição de sal a esta mistura permite a formação de uma solução aquosa de hipoclorito de sódio.
Do equilíbrio abaixo, você pode ver que a adição de ácidos a essa solução levará à reação à produção de gás cloro (à esquerda na reação abaixo).
Cl2 + 2 NaOH ![]() NaCl + NaOCl + H2O
NaCl + NaOCl + H2O
Assim, para que a reação prossiga no sentido direto (produção de hipoclorito) é necessário adicionar álcalis (bases), tais como o NaOH.
Um método de produção mais efetivo foi inventado na década de 1890 por E.S. Smith e envolvia eletrolisar uma solução salina para produzir NaOH e gás cloro, os quais eram misturados para formar o hipoclorito.
Nos dias atuais, o único método de escala industrial usado para a produção de hipoclorito é chamado de processo Hooker, e é apenas uma versão melhorada do processo de Smith.
Neste, o gás cloro (Cl2) é passado por uma solução resfriada de NaOH (hidróxido de sódio), formando o hipoclorito de sódio (NaOCl), com cloreto de sódio (NaCl - sal comum) como principal subproduto.
A reação de desproporcionamento (O Cl2 é simultaneamente oxidado e reduzido) é completada através de eletrólise, e a mistura deve ser mantida abaixo de 40ºC para prevenir a formação indesejada de clorato de sódio (NaClO3).
Cl2 + 2 NaOH ![]() NaCl + NaOCl + H2O
NaCl + NaOCl + H2O
Como o alvejante funciona?
O hipoclorito de sódio é altamente reativo, e também é muito instável.
Se deixado exposto à atmosfera, o gás cloro "evapora" da solução a uma taxa considerável, e se for aquecido o hipoclorito de sódio produz sal comum e oxigênio. Isso também acontece quando ele entra em contato com ácidos, luz solar, certos metais, muitos gases, e é uma das razões pelas quais a água sanitária pode ser usada em larga escala - após o uso ela se decompõe em produtos benignos (sal e água) os quais podem ser despejados no sistema de esgotos sem problemas.
O alvejante funciona de diversas maneiras. O ácido hipocloroso (HClO) é um agente oxidante muito forte (até mais forte que o gás cloro - Cl2), e pode reagir com e destruir muitos tipos de moléculas, incluíndo os corantes orgânicos presentes nas roupas.
Também o íon hipoclorito se decompõem em cloreto (Cl-) e em uma forma muito reativa de oxigênio:
2ClO- ![]() 2Cl- + O2
2Cl- + O2
O HClO (e em menor extensão o Cl2 e o oxigênio ativo) podem então ativar as ligações químicas de um composto colorido (e eles costumam possuir muitas ligações duplas conjugadas prontinhas para sofrer ataque químico), ou destruir os grupos cromóforos (a parte da molécula que confere cor ao composto por doação ou remoção de densidade eletrônica), ou convertendo as ligações duplas nos cromóforos em ligações simples, fazendo com que a molécula perca a capacidade de absorver luz visível.
Quando ele reage com micróbios, o hipoclorito de sódio ataca as proteínas das células causando a agregação destas e dos micróbios e fazendo com que eles morram.
Ele também pode causar a "queima" das membranas celulares. Esse ataque de amplo espectro faz com que o alvejante seja efetivo contra uma enorme gama de bactérias.
O hipoclorito de sódio é alcalino, e a água sanitária também contém NaOH para fazer a solução ficar ainda mais alcalina.
Duas substâncias são formadas quando o hipoclorito de sódio se dissolve em água: Elas são o ácido hipocloroso (HClO) e o íon hipoclorito (OCl-), a proporção das duas substâncias é determinada pelo pH da solução.
Efeitos colaterais perigosos

NH3 + NaOCl ![]() NaOH + NH2Cl
NaOH + NH2Cl
NH2Cl + NaOCl ![]() NaOH + NHCl2
NaOH + NHCl2
NHCl2 + NaOCl ![]() NaOH + NCl3
NaOH + NCl3
Outra reação possível com alguns produtos caseiros, tais como surfactantes e fragrâncias produz compostos orgânicos voláteis clorados (VOCs), tais como o tetracloreto de carbono (CCl4) e o clorofórmio (CHCl3), os quais podem ser danosos à saúde.
No entanto, o benefício gerado pela limpeza e desinfecção dos cômodos da sua casa provavelmente valem o risco corrido pela presença dessas substâncias na área de serviço (principalmente o risco de formação de VOCs).
A água sanitária pode reagir violentamente com peróxido de hidrogênio para produzir gás oxigênio O2::
H2O2(aq) + NaOCl(aq) ![]() NaCl(aq) + H2O(l) + O2(g)
NaCl(aq) + H2O(l) + O2(g)
No Brasil, se você necessitar de auxílio técnico para a manipulação de substâncias potencialmente tóxicas ou letais, contate o CIT da sua região através dos contatos abaixo:
Centros para buscar atendimento nas capitais
Região Sudeste
Belo Horizonte
Serviço de Toxicologia de Minas Gerais Endereço: avenida Professor Alfredo Balena, 400 - 1º andar - Santa EfigêniaHospital João XXIIITelefone: (31) 3224-4000 / (31) 3239-9308 / 3239-9224 / 0800-722-6001
São Paulo
Centro de Assistência Toxicológica - Instituto da Criança da Faculdade de Medicina da Universidade de São PauloEndereço: Hospital das Clínicasavenida Dr. Enéas de Carvalho Aguiar, 647 - 3º andar - Instituto da Criança - PinheirosTelefone: (11) 3069-8571 / 3088-7645 / 0800-148-110
Vitória
Centro de Atendimento Toxicológico do Espírito Santo - TOXCENEndereço: Hospital Infantil Nossa Senhora da GlóriaAlameda Mary Ubirajara, 205 - Santa LúciaTelefone: (27) 3137-2400 / 3137-2406 / 0800-283-9904
Região Sul
Curitiba
Centro de Controle de Envenenamentos de CuritibaSupervisora: Drª Marlene EntresEndereço: Hospital de Clínicas da UFPRRua General Carneiro, 180Telefone: (41) 3264-8290 / 3363-7820 / 0800-410-148
Florianópolis
Centro de Informações Toxicológicas de Santa CatarinaEndereço: Universidade Federal de Santa Catarina - Hospital Universitário - Bairro TrindadeTelefone: (48) 3721-9535 / 3721-9173 / 3331-9083 / 3331-9173 / 3331-9535 / 0800-643-5252
Porto Alegre
Centro de Informação Toxicológica do Rio Grande do SulEndereço: Rua Domingos Crescêncio, 132 - 8º andar - SantanaTelefone: (51) 2139-9200 até o 9299 / 0800-721-3000
Região Norte
Belém
Centro de Informações Toxicológicas de BelémEndereço: Hospital Universitário João de Barros BarretoRua dos Mundurucus, 4487 - GuamáTelefone: 0800-722601 / (91) 3249-6370 / 3259-3748
Manaus
Centro de Informações Toxicológicas do AmazonasEndereço: Hospital Universitário Getúlio Vargasavenida Apurinã, 4 - Praça 14Telefone: (92) 3622-1972 / 3621-6502 / 3621-6500 / 0800-722-6001
Região Nordeste
Aracaju
Centro de Informação e Assistência Toxicológica de SergipeEndereço: avenida Tancredo Neves, s/nº - Hospital Governador João Alves Filho - CapuchoTelefone: (79) 3259-3645 / PABX do Hospital (79) 3216-2600 Ramal 2677
Fortaleza
Centro de Assistência Toxicológica de FortalezaEndereço: Instituto Dr. José FrotaRua Barão do Rio Branco, 1816 - CentroTelefone: (85) 3255-5050 / 3255-5012
João Pessoa
Centro de Assistência Toxicológica da ParaíbaEndereço: Hospital Universitário Lauro WanderleyCidade Universitária - Campus ITelefone: (83) 3216-7007 / 3224-6688 / 3262-0555 / 0800-722-6001
Recife
Centro de Assistência Toxicológica de PernambucoEndereço: Hospital da Restauração - 1º andarAvenida Agamenon Magalhães, s/nº - DerbyTelefone: (81) 3181-5458 / 3181-5400
Salvador
Centro de Informação Anti-Veneno da BahiaEndereço: Hospital Geral Roberto SantosRua do Saboeiro, s/nº - CabulaTelefone: (71) 3387-4343 / 3387-3414 (diretoria) / 0800 284-4343
Teresina
Centro de Informações Toxicológicas (Citox)Endereço: Rua 19 de novembro, 1865 - Bairro PrimaveraTelefone: (86) 3221-9608 / 3216-3660 / 3216-3662 / 0800-280-3661 (Vig. Sanitária)
Região Centro-Oeste
Brasília
Centro de Informação e Assistência Toxicológica do Distrito FederalEndereço: LACEN-DF - SGAN - nº 601 Norte Telefone: (61) 3225-6512 / 3325-6773/ 0800 644-6774
Campo Grande
Centro Integrado de Vigilância Toxicológica de Mato Grosso do SulEndereço: Hospital Regional do Mato Grosso do SulAvenida Engenheiro Luthero Lopes, 36 - Bairro Aero RanchoTelefone: (67) 3386-8655 / 3378-2558 / 3318-1670 / 0800-722-6001
Cuiabá
Centro de Informação Anti-Veneno de CuiabáEndereço: Hospital Municipal e Pronto Socorro de CuiabáAvenida General Vale, 192 - Bairro BandeirantesTelefone: (65) 3051-9454 / 3051-9450 / 3617-1374 / 0800- 722-6001
Goiânia
Centro de Informações Tóxico-Farmacológicas de GoiásEndereço: Superintendência de Vigilância SanitáriaAvenida Anhanguera, 5195 - Setor CoimbraTelefone: (62) 3291-4350 / 3201-4110 / 3201-4111/ 0800-646-4350





Faz tempo que eu não escrevo um post para essa seção do blog, então hoje eu resolvi tirar a poeira e falar sobre uma molécula interessante e sobre algumas curiosidades acerca dela.
A capsaicina é o principal componente das pimentas, é um composto incolorm inodoro e insípido.
Sua fórmula molecular é (CH3)2CHCH=CH(CH2)4CONHCH2C6H3-4-(OH)-3-(OCH3).
Sua fórmula estrutural plana é

A forma espacial do confôrmero estável da capsaicina pode ser representada por:

O nome IUPAC é 8-Metil-N-vanillil-trans-6-nonanamida.
Também atende pelos nomes de (E)-N-(4-Hidróxi-3-metóxibenzil)-8-metilnon-6-anamida, trans-8-Metil-N-vanillilnon-6-anamida, (E)-Capsaicin,CPS ou simplesmente C.
A capsaicina é irritante para os mamíferos, incluíndo estes que andam sobre duas patas e se chamam de humanos.
Ela produz uma sensação de queima nos tecidos com os quais entra em contato.
Ela é, na verdade, o ápice de uma série de compostos chamados de capsaicinoides e que são metabólitos secundários produzidos por pimentas chilli, provavelmente como defensivos naturais contra certos herbívoros e fungos.
A capsaicina pura é hidrofóbica (odeia água), é incolor, sem odor e tem aspecto cristalino ou até de cera.
Isso significa que se você comeu um pouco de pimenta ardida não adianta muito tomar água. Você precisa ingerir algo que dilua a capsaicina, como óleo, azeite ou até mesmo leite.
O composto foi extraído pela primeira vez em 1815 por Christian Friedrich Bucholz.
Em 1930 ela foi sintetizada em laboratório por E. Spath e S. F. Darling.
Em 1873, o farmacologista Alemão Rudolf Buchheim, seguido pelo Dr húngaro Endre Hőgyes (1878), descobriram que a sensação de queimação era produzida quandoa substância entrava em contato com as membranas mucosas e aumentava a secreção de suco gástrico.
Além dos seus óbvios usos culinários (tem louco pra tudo), ela tem aplicações médicas.
Ela é usada em cremes contra dores musculares, neurálgicas, artríticas e dores nas costas. Existem cremes para tratamento da psoríase que usam a capsaicina como componete ativo.
Também é vendida na forma de bandagens para aplicação direta no local dolorido.
Alguns estudos afirmam que, por elevar a temperatura corporal por algum tempo, a capsaicina pode ser usada para regular níveis de açúcar no sangue e, por isso, pode ser usada em tratamentos contra o diabetes e também contra a obesidade.
CURIOSIDADE
A escala Scoville
Em 1912, enquanto trabalhava para uma farmacêutica, o farmacologista e químico Wilbur Scoville desenvolveu um método para medir o "grau de calor" das pimentas.
Este teste é chamado de Teste Organoléptico de Scoville ou Procedimento de Diluição e Prova.

Um extrato alcoólico do óleo de capsaicina obtido de uma medida de pimenta seca é adicionado incrementalmente a uma solução aquosa de açúcar até que o "calor" provocado pela ingestão dessa solução não seja mais detectado por um grupo de pelo menos cinco provadores humanos (coitados).
O grau de diluição dá uma medida na escala Scoville.
Um simples pimentão possui um valor de zero na escala, pois não possui capsaicina detectável por humanos.
As pimentas chilli, por sua vez, tem um valor na escala que equivale a 200.000 ou mais, indicando que seus extratos precisam ser diluídos 200,000 vezes antes da capsaicina presente se tornar indetectável.
O grande problema nesse método é que ele se baseia em impressões humanas e, portanto, é muito impreciso e subjetivo.
Cada testador (coitado), só pode provar uma amostra por sessão.
A capsaicina quando pura equivale a 15 milhões de unidades Scoville!!!!!! Ou seja, precisa ser diluída 15.000.000 de vezes para poder se tornar indetectável.
Se você beber uma simples xícara de capsaicina pura, terá que tomar 15.000.000 de xicaras de água para não morrer de queimadura, hehehehe.
Veja uma imagem bem ilustrativa que mostra o poder relativo das pimentas.

Então tá, fica aí a minha dica "quente" de molécula do dia!
E na próxima vez que você provar uma pimenta um pouco mais ardida e tiver que soltar uma lágrima máscula pelo canto do olho, apenas diga com firmeza:
"Não estou chorando por causa da pimenta, é que estou com saudades da minha terra natal!"
Uma boa sexta-feira a todos!
Então, ja que estou curtindo umas merecidas férias, vou fazer um post copy+paste para não deixar o meu querido blog às moscas.
Ressucitei a seção molécula do dia com uma macromolécula que tem um valor especial para mim, o poli(butadieno).
Vou fazer uma mescla de dois artigos sobre esse elastômero que eu garimpei na rede.
Segue a cópia descarada dos artigos:

As bolinhas que ‘pulam longe’ fazem a diversão de crianças em todo o mundo; conheça um pouco mais sobre elas.
Chamadas em alguns países de superballs, estas estruturas esféricas são produzidas com um material chamado polibutadieno vulcanizado. Este composto foi sintetizado pela primeira vez em 1965, pelo pesquisador Norman Stingley. O que fez dessa bolinha um sucesso no mundo são suas propriedades excepcionais.
As moléculas de polibutadieno são longas cadeias de átomos de carbono, basicamente falando. Essas cadeias funcionam como verdadeiros elásticos, conseguindo recuperar sua forma original quando esticadas ou colocadas sob pressão mecânica. Quando o polibutadieno é aquecido em altas pressões com enxofre, ocorre um processo chamado vulcanização. Este tipo de acontecimento introduz átomos de enxofre entre as ligações de carbono, formando redes extremamente longas.
Neste momento, é como se o enxofre torna-se uma ponte, ligando uma “parede” de carbono a outra. Quando você joga uma dessas bolinhas no chão, sua forma original é distorcida. As pontes de enxofre limitam e dizem quanto uma bola conseguirá pular. Estudos mostraram que 92% da energia que você aplica ao arremessar uma bolinha no chão, continua armazenada na própria bolinha, mesmo após ter atingido o chão. Isso explica o motivo pelo qual pulam tão alto.
Após a descoberta deste material inacreditavelmente elástico, Norman Stingley começou a fabricar em tamanhos pequenos e esféricos, em uma empresa chamada Manufacturing Company Wham-O, incentivando as crianças ao redor do mundo a pegarem a bolinha e atirá-la com toda a força possível contra o chão para entenderem que não se tratava de mais uma bolinha qualquer.
No vídeo abaixo você tem uma noção de como essas bolinhas são divertidas, especialmente para as crianças. Que tal jogar milhares delas, todas de uma vez, do alto de uma escada?
A parte técnica sobre o poli(butadieno) está na sequência do post. Siga lendo.
A borracha de polibutadieno também chamada simplesmente de borracha de butadieno, é predominantemente baseada no cis-1,4 polibutadieno. A estrutura do polibutadieno [-CH2-CH=CH-CH2-]n obtido a partir do 1,3 butadieno (CH2=CH-CH=CH2) indica que, preferencialmente, se dá a adição-1,4 sendo de realçar que a cadeia carbonada possui, ainda, uma ligação dupla.
O polibutadieno é um homopolímero de butadieno, C4H6, e é obtido por polimerização por solução, a mais vulgar. Pode também ser polimerizado por emulsão [1]. O polibutadieno polimeriza por adição, quer a forma vinilo 1,2 quer a forma trans-1,4 ou cis-1,4. A fig.1 mostra as cinco formas segundo as quais a unidade de butadieno se pode juntar à cadeia do polímero.

Estruturas de polibutadieno:(a)trans-1,4 adição, (b)cis-1,4 adição, (c) vinilo-1,2 adição, sindiotáctico, (d) vinilo-1,2 adição, isotáctico, (e) vinilo-1,2 adição, heterotáctico ou atáctico.
A escolha do agente catalítico condiciona o tipo de polibutadieno obtido, podendo variar de quase 100% cis a 100% trans ou 100% vinilo [1]. O grau com um conteúdo em cis-1,4 de cerca de 97% é produzido utilizando um agente catalítico de cobalto. O grau de polímero cis mais popular, com cerca de 92-93% de cis, é obtido com um agente catalítico de halogeneto de titânio, enquanto que o grau de polímero com baixo teor em cis, cerca de 37-40%, usa um agente catalítico alquil litio [1]. Também são usados, para além dos já referidos Litio (Li) e Titânio (Ti), outros agentes catalíticos, tais como, Cobalto (Co), Neodímio (Nd) e Níquel (Ni). Estes agentes catalíticos podem ser metálicos na forma de sal ou compostos organometálicos.
Na produção do polibutadieno (BR) os parâmetros de polimerização a seguir indicados são relevantes e distinguem os diferentes graus obtidos [2]:
- tipo de inicializador (tipo de BR);
- tipo de estabilizador e sua concentração (diferença em “staining” ou “ não staining”e estabilidade de armazenagem);
- tipo de cadeia, peso molecular (diferença na viscosidade Mooney e processabilidade);
- tipo e quantidade de óleo extendedor (oil extender rubber);
- tipo e quantidade de negro de carbono utilizado (carbon black masterbatches).
Conforme já referido, o agente catalítico tem também uma influência marcante na microestrutura da borracha de polibutadieno, o que determina, em grande parte, as propriedades dos vulcanizados [2]. Quanto maior o conteúdo em cis-1,4 da borracha de polibutadieno (BR), menor é a sua temperatura de transição vítrea, Tg. Os graus puros de cis-1,4 BR têm uma Tgde -100°C, enquanto que os graus comerciais com cerca de 96% de teor em cis-1,4 têm uma temperatura de transição vítrea de -90°C. A temperatura de transição vítrea aumenta linearmente com o aumento de concentração da estrutura 1,2 (teor em vinilo) [2].
Tal como na borracha de butadieno estireno (SBR), também existem graus de polibutadieno com óleo e negro de carbono.
O polibutadieno é a única borracha sintética cujos vulcanizados apresentam uma maior elasticidade que a dos vulcanizados de borracha natural (NR), o que significa, por outro lado, que a histeresis é limitada e que a resistência à abrasão e a flexibilidade a baixas temperaturas são superiores [3]. Têm uma resistência ao calor superior à dos vulcanizados de NR e semelhante à dos vulcanizados de SBR. Por outro lado, a aderência ao solo de misturas com cerca de 50-60% de BR é bastante baixa, o que, por vezes, é completamente desaconselhável.
A tensão de rotura dos vulcanizados de BR com alto teor em cis-1,4 é consideravelmente menor do que a de vulcanizados comparáveis baseados em NR ou SBR. Todavia, as misturas com NR ou SBR podem satisfazer propriedades técnicas de vulcanizados de BR com exigências de elevada qualidade. Por outro lado, as propriedades dos vulcanizados de NR ou SBR são melhoradas, em diferentes aspectos, quando se lhes adiciona cis-1,4 BR, devido à baixa Tg deste.
Os graus puros de cis-1,4 BR conferem aos vulcanizados uma melhor resistência à abrasão mas pobre tracção quando molhados (wet traction). À medida que o conteúdo em vinilo-1,2 aumenta, a resistência do polibutadieno à abrasão piora e a tracção quando molhado melhora, pelo que, para aplicações concretas é necessário encontrar um compromisso. Com a excepção da borracha natural epoxidada (ENR), a resistência à abrasão é ganha, em regra geral, à custa da tracção quando molhado (wet traction).
Pela dificuldade de processamento, nomeadamente nos moinhos de rolos, e para que algumas propriedades dos vulcanizados baseados em BR possam atingir níveis elevados, a borracha de polibutadieno é sobretudo usada em misturas com NR ou SBR, conforme já referido. Estas misturas permitem incorporar maiores quantidades de negro de carbono (negro de fumo) e de óleo, e proporcionam a obtenção de maior velocidade de extrusão, maior tensão de rotura e melhor flexibilidade a baixa temperatura [2].
As vantagens do uso de misturas de borracha de polibutadieno (BR) com borracha natural (NR), com borracha de butadieno estireno (SBR), com borracha de isopreno (IR) e, se necessário também com borracha de policloropreno (CR) ou de acrilonitrilo butadieno (NBR), dividem-se em vantagens no processo de fabrico e melhoria nas propriedades dos vulcanizados [4].
Vantagens no processo de fabrico:
- maior velocidade de extrusão;
- maior estabilidade dimensional;
- maior fluxo durante a moldação;
- maior resistência à reversão;
- maior possibilidade de aumentar a quantidade de negro de carbono e óleo;
- redução da adesão aos rolos dos misturadores abertos nos compostos de CR.
Melhoria nas propriedades dos vulcanizados:
- maior resistência à abrasão;
- melhores propriedades elásticas;
- maior resistência à fadiga por flexão;
- maior flexibilidade a baixas temperaturas;
- maior resistência ao envelhecimento.
Piso de pneus, solas, correias transportadoras e de transmissão, revestimento de rolos e outras aplicações que necessitem de um composto com resistência à reversão.
REFERÊNCIAS BIBLIOGRÁFICAS
[1] - BARLOW, FRED. ,Rubber Compounding - Principles, Methods and Technics, Marcel Dekker, 1988.
[2] - HOFMANN W. , Rubber Technology Handbook, Hanser, New York, 1989.
[3] - NAGDI, KHAIRI, Manualle della Gomma, Tecniche Nuove, 1987.
[4] - MANUAL FOR THE RUBBER INDUSTRY, Development Section, Leverkusen, Bayer AG, 1993.
A seção "molécula do dia" de hoje é especial.
Especial porque vamos mostrar uma molécula importantíssima, presente em todo o universo e provavelmente será o futuro da geração de energia.
Especial porque vamos apresentá-la na forma de um prezi.
Especial porque o prezi que vamos apresentar não foi feito por mim, mas por um leitor do blog.
O Luiz Vitor, que mora em Joinville/SC e é técnico em Química Industrial, preparou essa apresentação especial e me enviou o link, eu gostei da apresentação e solicitei a permissão dele para publicar aqui no blog.
Então Luiz Vitor, aí vai o seu prezi aqui no "Diário de um Químico Digital".
Muito obrigado pela contribuição e parabéns pelo prezi que está muito bom.
Hidrogênio on Prezi
Esse post é baseado em um projeto da Sociedade Brasileira de Química chamado "365 dias de Química", que se dedica a falar de uma molécula por dia durante um ano. Esse projeto é uma das atividades referentes ao ano internacional da Química, que acontece durante todo o ano de 2011 e se estenderá até um pedacinho de 2012.
A Cadaverina, 1,5-diaminopentano, fórmula C5H14N2 - 102,178 g.mol-1 é uma substância líquida (T.F. 9ºC; T.E. 178-180ºC) nas condições ambiente.
A Putrescina, 1,4-diaminobutano, fórmula C4H12N2 - 88,152 g.mol-1 é uma substância líquida (T.F. 27ºC; T.E. 158-160ºC) nas condições ambiente.
Em ambas as moléculas salienta-se:
1. Grupo amina (-NH2).
2. Cadeia carbônica (CH2)n.
Nas fases iniciais após a morte, o nosso metabolismo celular começa a diminuir de acordo com a falência do sistema interno. A falta de oxigênio nos tecidos provoca um grande crescimento de bactérias, que se alimentam de proteínas, carboidratos e gorduras do organismo, produzindo gases que fazem o corpo inchar e que dão o mau odor característico dos cadáveres. Em 1885, o médico alemão Ludwig Brieger identificou dois compostos nitrogenados, a cadaverina e a putrescina, como os principais responsáveis pelo cheiro de putrefação. De fato, existem uma série de compostos voláteis envolvidos no processo de putrefação, que incluem também substâncias relacionadas ao ácido butírico.
A cadaverina e a putrescina não estão somente associadas ao processo de putrefação, podendo também ser produzidas nos organismos vivos. Elas são responsáveis, em parte, pelo cheiro de fluidos corporais, como a urina e o sêmen, cheiro da manteiga rançosa, mau hálito, queijos fedorentos, etc. Algumas bactérias produzem normalmente a cadaverina pela degradação de proteínas.
A cadaverina e a putrescina são produzidas através da descarboxilação de ácidos aminados. A cadaverina é gerada após a descarboxilação da lisina pela enzima lisina descarboxilase, enquanto que a putrescina é gerada após a descarboxilação da ornitina.
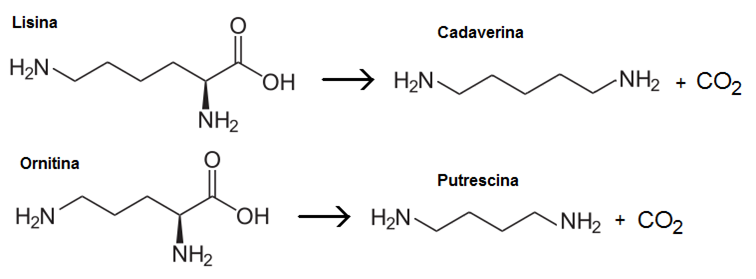
A cadaverina e a putrescina diferem em apenas um CH2. Essa diferença é devido a presença de um carbono a mais no ácido aminado lisina, em relação à ornitina.
Os grupos amina (-NH2) presentes nas extremidades das moléculas são os responsáveis pelo seu mau odor. As aminas, em geral, possuem um odor nauseante e desagradável.
Níveis elevados de cadaverina e putrescina na urina podem ser indicativos de alguma falha no metabolismo dos ácidos aminados.
Eu andava com saudades dessa seção aqui do blog, então resolvi falar de uma molécula que me é muito útil, o omeprazol.
Eis a criança:
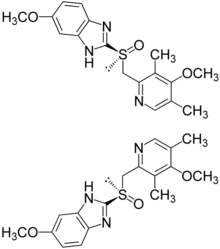
O nome IUPAC dessa molécula é (RS)-5-metóxi-2-[(4-metóxi-3,5-dimetil-piridin-2-il)metilsulfinil]-3H-benzimidazol.
Sua fórmula molecular é C17H19N3O3S.
É utilizado no tratamento das úlceras, esofagites de refluxo e na erradicação da bactéria helicobacter pyllori.
Sua ação baseia-se na inibição da bomba de prótons e, com isso, ajudam a reduzir a acidez diminuindo em até 99% a secreção de ácidos estomacais/gastrointestinais.

Essa fantástica molécula cura até 85% dos casos de esofagite de refluxo (isso é chato, eu garanto), 90% das úlceras gástricas e duodenais (em no máximo dois meses).

Como estou com pouco tempo para escrever, vou parar o post por aqui.
Prometo deixar o blog um pouco mais ativo no próximo mês!
Obrigado por visitarem meu humilde site. :)