



| MQEVNKQFNY | KDPVNGVDIA | YIKIPNVGQM | QPVKAFKIHN | KIWVIPERDT |
| FTNPEEGDLN | PPPEAKQVPV | SYYDSTYLST | DNEKDNYLKG | VTKLFERIYS |
| TDLGRMLLTS | IVRGIPFWGG | STIDTELKVI | DTNCINVIQP | DGSYRSEELN |
| LVIIGPSADI | IQFECKSFGH | EVLNLTRNGY | GSTQYIRFSP | DFTFGFEESL |
| EVDTNPLLGA | GKFATDPAVT | LAHELIHAGH | RLYGIAINPN | RVFKVNTNAY |
| YEMSGLEVSF | EELRTFGGHD | AKFIDSLQEN | EFRLYYYNKF | KDIASTLNKA |
| KSIVGTTASL | QYMKNVFKEK | YLLSEDTSGK | FSVDKLKFDK | LYKMLTEIYT |
| EDNFVKFFKV | LNRKTYLNFD | KAVFKINIVP | KVNYTIYDGE | NLRNTNLAAN |
| FNGQNTEINN | MNFTKLKNFT | GLFEFYKLLV | VRGIITSKTK | SLDKGYNKAL |
| NDLQIKVNNW | DLFFSPSEDN | FTNDLNKGEE | ITSDTNIEAA | EENISLDLIQ |
| QYYLTFNFDN | EPENISIENL | SSDIIGQLEL | MPNIERFPNG | KKYELDKYTM |
| FHYLRAQEFE | HGKSRIALTN | SVNEALLNPS | RVYTFFSSDY | VKKVNKATEA |
| AMFLGWVEQL | VYDFTDETSE | VSTTDKIADI | TIIIPYIGPA | LNIGNMLYKD |
| DFVGALIFSG | AVILLEFIPE | IAIPVLGTFA | LVSYIANKVL | TVQTIDNALS |
| KNEKWDEVYK | YIVTNWLAKV | NTQIDLIRKK | MKEALENQAE | ATKIINYQYN |
| QYTEEEKNNI | NFNIDDLSSK | LNESINKAMI | NINKFLNQSV | SYLMNSMIYG |
| VKRLEDFDAS | LKDALLKYIY | DNRGTLIGQV | DRLKDKVNNT | LSTDIPFQLS |
| KYVDNQRLLS | TFTEYIKNII | NTSILNLRYE | SNHLIDLSRY | ASKINIGSKV |
| NFDPIDKNQI | QLFNLESSKE | EVILKNAIVY | NSMYENFSTS | FWIRIPKYFN |
| SISLNNEYTI | INCMENNSGW | KVSLNYGEII | WTLQDTQEIK | QRVVFKYSMQ |
| MINISDYINR | WIFVTITNNR | LNNSKIYING | RLIDQKPISN | LGNIHASNNI |
| MFKLDGCRDT | HRYIWIKYFN | LFDKELNEKE | IKDLYDNQSN | SGILKDFWGD |
| YLQYDKPYYM | LNLYDPNKYV | DVNNVGIRGY | MYLKGPRGSV | MTTNIYLNSS |
| LYRGTKFIIK | KYASGNKDNI | VRNNDRVYIN | VVVKNKEYRL | ATNASQAGVE |
| KILSALEIPD | VGNLSQVVVM | KSKNDQGITN | KCKMNLQDNN | GNDIGFIGFH |
| QFNNIAKLVA | SNWYNRQIER | SSRTLGCSWE | FIPVDDGWGE | RPL |
| Letra | Aminoácido | Aminoácido Radical |
|---|---|---|
| A | Alanina | alanil |
| C | Cisteína | cisteinil |
| D | Ácido aspártico | aspartil |
| E | Ácido Glutâmico | glutamil |
| F | Fenilalanina | fenilalanil |
| G | Glicine | glicil |
| H | Histidina | histidil |
| I | Isoleucina | isoleucil |
| K | Lisina | lisil |
| L | Leucina | leucil |
| M | Metionina | metionil |
| N | Asparagina | asparaginil |
| P | Prolina | prolil |
| Q | Glutamina | glutaminil |
| R | Arginina | arginil |
| S | Serina | seril |
| T | Treonina | treonil |
| V | Valine | valil |
| W | Triptofano | triptofanil |
| Y | Tirosina | tirosil |

Calma gente, não desaprendi Química (ainda).
A imagem acima é do produto comercializado em farmácias sob o nome "merthiolate" por razões, como podería dizer, "puramente comerciais" (dãããã).
O fato é que esse anti-séptico (maldito acordo ortográfico) foi vendido durante muitos anos com o princípio ativo mertiolato , cujo nome químico mais correto seria tiomersal ou timersal, um composto salino de mercúrio.
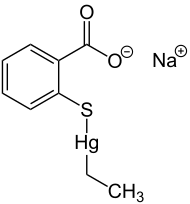
Agora, vocês imaginam o porquê dele ter sido banido das farmácias? Ora bolotas, o treco é um tiossal de mercúrio, é tóxico "bagarai" e as mães passavam em qualquer machucado dos pimpolhinhos.
Devido a essa elevada toxicidade, o ministério da saúde (que deve ter imitado a FDA) baniu a bagaça das nossas vidas.
Em substituição a essa substância veio o digluconato de clorexidina (finalmente cheguei no assunto do post). A formuleta da criança tá aí abaixo:

Ele é um anti-séptico com ação antifúngica (Super Mario sempre anda com um frasquinho no bolso) e bactericida, além de ser bacteriostático (além de matar as blacktérias, não deixa que elas se proliferem).
Sua DL50 (dose letal capaz de matar 50% de uma população) é de 1800 mg/kg de massa corporal/dia.
Ele não exala vapores, não irrita a pele e nem as mucosas e não polui (claro, não possui mercúrio na fórmula).
Sob concentrações elevadas ele pode causar danos severos à córnea e até causar surdez.
O nome químico da clorexidina é 1,1-bis-hexametileno-(5-p-Clorofenilbiguanida)-di-D-Gluconato. Sua fórmula química é C22H30Cl2N10.
Apenas a título de complementação, o antigo mertiolato tem nome químico Etil-(2-mercaptobenzoato-(2-)-O,S)mercuriato(1-) sódico.
Bom, era isso. Matei minha vontade de falar sobre essa molécula.
Fiquem ligados para mais um "molécula do dia" a qualquer momento.
P.S.:Químicos orgânicos de plantão, sintam-se livres para corrigir nomes químicos das minhas moléculas. :)
Foi descoberta por Ascanio Sobrero (1812-1888) em 1847, que primeiramente a chamou de "piroglicerina", misturando a glicerina, ácido sulfúrico e ácido nítrico.
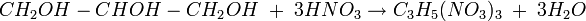
Em 1867, Alfred Nobel (criador do famoso prêmio que leva o seu sobrenome), instalou uma fábrica de nitroglicerina na qual fazia a nitroglicerina ser absorvida por um material poroso, absorvente e inerte como a sílica (areia, para fins de simplificar as coisas), pós de cerâmicas, argila seca, gesso, carvão e terras diatomáceas, obtendo uma massa moldável. Essa massa foi patenteada com o nome de dinamite.

Para vocês terem uma ideia do poder explosivo da nitroglicerina, se a gente pegar uns 900 gramas (4 mols) dela dá para obter até 53 mols de substâncias gasosas em estado superaquecido.
Usando a já manjada equação dos gases ideiais, 53 mols de gás rendem algo em torno de 1270 litros de gás a 25ºC.
Essa reação acontece muito rápido e uma enorme onda de choque é gerada, fazendo com que tudo à volta do explosivo detonado seja despedaçado.
A nitroglicerina é usada em medicina como vasodilatador. Quem tem artérias entupidas pode receber uma dose do medicamento na forma de injeção ou via oral. Outras drogas modernas destinadas ao uso médico são baseadas na fórmula da nitroglicerina.
Para encerrar com chave de ouro esse post, uma explosão em câmera lenta da nossa amiga nitroglicerina:


| NOME : | N,N-DimetIltrIptamina |
| NOME QUÍMICO : | N,N-DimetIl-1H-indolo-3-etanamina |
| NOMES QUÍMICOS ALTERNATIVOS : | 3-[2-(dimetilamino)etil]indol, DMT |
| FÓRMULA QUÍMICA | C12H16N2 |
| MASSA MOLAR | 188.27 |
| PONTO DE FUSÃO | 44.6-46.8°C (116°F) (cristais) |
| PONTO DE EBULIÇÃO | 60-80°C (cristais) |
Assasinos silenciosos.
Episódio de hoje: monóxido de carbono

Monóxido de carbono (CO), também chamdo de óxido carbônico, é um gás incolor, inodoro e sem sabor que é ligeiramente mais leve que o ar. É altamente tóxico para humanos e animais em doses elevadas, apesar de ser produzido pelo metabolismo normal de animais em baixas quantidades, e acredita-se que tenha algumas funções biológicas.
Consiste de um átomo de carbono e um de oxigênio, conectados entre si por uma ligação covalente tripla.
Ele é o composto oxocarbônico mais simples, e é um anidrido (derivado por perda de uma molécula de água) do ácido fórmico. Em complexos de coordenação ele recebe o nome de carbonila.
Ele é produzido da oxidação parcial de compostos contendo carbono; ele se forma quando não existe oxigênio suficiente para produzir o dióxido de (mono)carbono (CO2), como em fornos ou motores a combustão em espaços confinados.
Na presença de oxigênio, ele queima com uma chama azul, produzindo o (CO2). Gás mineral, que foi amplamente usado até os anos de 1960 para iluminação doméstica, alimentação e aquecimento a despeito de sua toxicidade continha dióxido de carbono como seu principal componente. Alguns processos de tecnologia moderna, tais como a fundição do ferro, ainda produzem o CO como principal sub-produto.
Devido a reações fotoquímicas na troposfera, a maior fonte de CO é natural, respondendo por 5 x 1012 kg/ano. Vulcões, incêndios florestais e outras formas de combustão são fontes importantes de CO.
Em biologia, o monóxido de carbono é naturalmente produzido pela ação da heme oxigenase 1 e 2 no grupamento HEME da hemoglobina. Esse processo produz uma certa quantidade de carboxihemoglobina em pessoas normais, mesmo se elas não respirarem qualquer quantidade de monóxido de carbono.
Há relatos de que o monóxido de carbono é um neurotransmissor normal, bem como um dos três principais gases que naturalmente modula respostas inflamatórias no corpo (os outros dois são o monóxido de nitrogênio - NO - e o sulfeto de hidrogênio - H2S.), o monóxido de carbono recebeu uma grande atenção como um regulador biológico.
Em muitos tecidos, todos os três fases são conhecidos por atuar como anti-inflamatórios, vasodilatadores e encorajadores do crescimento neovascular. Tentativas clínicas de tratamentos com pequenas quantidades de CO como droga estão em andamento.
Agora, a parte que interessa: Ele é o agente de envenenamento do ar mais comum em muitos países. Quando combinado com a hemoglobina, forma a carboxihemoglobina, que é ineficaz na entrega de oxigênio aos tecidos corporais. Essa condição é conhecida como anoxemia.
Concentração em torno de 667 ppm podem causar conversão de até 50% da hemoglobina do corpo na forma carboxi.
Os sintomas mais comuns de envenenamento por monóxido de carbono podem assemelhar-se a outros tipos de envenenamentos e infecções, incluindo sintomas tais como dor-de-cabeça, náusea, vômito, confusão, fadiga e um sentimento de fraqueza. Crianças podem ficar irritáveis e se alimentar mal. Sinais neurológicos incluem confusão, desorientação, distúrbios visuais, síncope e tonturas.
Algumas pessoas descrevem que o envenenamento por CO inclui hemorragias visuais, e uma tonalidade vermelho-cereja no sangue.
Liga-se a outras moléculas como a mioglobina e citocromo mitocondrial oxidase. Exposições ao CO podem causar danos significativos ao coração e sistema nervoso central.
Ocorrência atmosférica
Se você quiser produzir o CO em laboratório, basta fazer uma reação entre o zinco metálico e o carbonato de sódio:
- Zn + CaCO3 → ZnO + CaO + CO
Obviamente o CO não é apenas um assassino, isso foi só uma brincadeira que eu fiz para justificar o uso da imagem acima. Ele tem importantes aplicações industriais, científicas e até mesmo médicas. Se eu tiver paciência, posto essas outras informações aqui no blog num futuro próximo.
O dióxido de carbono é uma das mais simples e comuns moléculas do universo (perde para o gás hidrogênio). Possui apenas três átomos, um de carbono e dois de oxigênio.
É fácil para os átomos de carbono unirem-se aos átomos de oxigênio por causa da camada de valência incompleta do carbono.
O carbono possui apenas quatro elétrons na última camada e, de acordo com um princípio bem simples, a tendência dos átomos é receber ou doar elétrons a fim de atingir uma configuração eletrônica de gás nobre.
Em termos mais simples, os átomos tendem a adquirir oito elétrons na camada mais externa. Isso não é uma obrigação, regra do octeto no ecziste, ok?
O carbono vai tender a receber quatro elétrons de outros átomos e, dessa forma, vai atingir um número de 8 elétrons na camada de valência e igualar-se ao gás nobre neônio, que também possui os tais oito elétrons na última camada.
Os átomos de oxigênio, por sua vez, possuem seis elétrons na camada de valência. Precisam de mais dois elétrons para completar o número mágico de 8 elétrons. Ao se ligar covalentemente ao carbono, eles compartilham dois elétrons com ele e, em troca, o carbono compartilha dois elétrons com cada oxigênio.
Esse troca-troca é melhor compreendido com a figurinha abaixo:
Existem moléculas de dióxido de (mono)carbono no espaço sideral. Esse dióxido formou-se nas nebulosas após a explosão das supernovas (estrelas recém-formadas). Todo o dióxido de carbono do espaçõ é muito frio, por isso ele encontra-se na forma de gelo.
Quando os planetas se formaram a partir dessas nebulosas, alguma parte do dióxido de carbono sólido tornou-se parte desses planetas. Existe, por exemplo, dióxido de carbono em Marte e em outros planetas, bem como na Terra.
Devido ao fato de que a superfície da Terra é muito mais quente do que o espaço, a maior parte do dióxido de carbono na Terra fundiu e tornou-se gás. Menos de um porcento do nosso ar é composto por dióxido de (mono)carbono, mas ele é muito importante para todos os seres vivos do planeta Terra.
As plantas produzem suas células a partir do processo conhecido por fotossíntese, no qual elas consomem dióxido de carbono. Para tanto, elas quebram a molécula de dióxido de carbono com a ajuda de enzimas específicas e utilizam o carbono para produção de células e de seiva. O oxigênio não utilizado é liberado para a atmosfera, repondo o oxigênio à mesma.
Quando a planta morre, seus átomos de carbono retornam ao solo ou à atmosfera na forma de dióxido de carbono.

Nos últimos cem anos, o dióxido de monocarbono tornou-se um problema grande para os habitantes do planeta Terra. Devido ao consumo de derivados do petróleo e à queima de carvão para fins de aquecimento, a quantidade de dióxido liberada na atmosfera deu saltos enormes.
Esse dióxido liberado é ótimo para as plantas, mas ele também atua como um cobertor, impedindo que o calor liberado pelo planeta escape para fora da atmosfera. Esse efeito é conhecido pelo nome de "efeito estufa" (greenhouse effect).
Esse tal efeito estufa tem preocupado os cientistas nas últimas décadas, pois o aumento de um simples grau na temperatura média mundial é o suficiente para acelerar o processo de derretimento das calotas polares e, quem sabe, contribuir para o aumento do nível do mar.
Pode ser que dentro de alguns anos vejamos cidades desaparecendo sob a água proveniente do derretimento do gelo polar.
Quanto às propriedades químicas dessa molécula:
A ligação química C-O é polarizada, só que devido à alta simetria da molécula, a polaridade é nula. Isso faz com que o átomo de carbono possua baixa densidade de elétrons ao seu redor e faz com que os átomos de oxigênio acumulem boa parte da densidade eletrônica da molécula ao seu redor.
Como resultado, temos um átomo de carbono ávido por elétrons e dois átomos de oxigênio ávidos por cargas positivas.
O encontro entre uma molécula de dióxido de carbono e uma molécula de água é bem interessante. A água possui dois átomos de hidrogênio ávidos por cargas negativas, e um átomo de oxigênio ávido por cargas positivas.
Uma molécula de água complementa uma de dióxido. O resultado da reação é a formação do ácido carbônico (H2CO3).
Todos os óxidos moleculares fazem essa mesma reação com a água, produzindo ácidos.
Sendo assim, costuma-se dizer que o dióxido de carbono é óxido molecular ou óxido ácido.
Para complementar o vídeo do post de ontem, um pouco mais sobre essa fantástica substância que é o cloreto de sódio.
Continue lendo na sequência...
Conhecido pelo nome químico de cloreto de sódio, pelo nome comercial de sal de cozinha ou sal comum, pelo nome mineralógico de halita, é um composto químico de fórmula mínima NaCl.
É um composto cujas ligações são predominantemente iônicas, ou seja, os átomos que compõem o NaCl encontram-se na forma ionizada (íons Na+ e Cl−).

Isso acontece porque os elementos químicos do grupo 1, ao qual o sódio pertence, possuem baixa energia de ionização e formam íons +1 com grande facilidade. Já os elementos químicos do grupo 17, ao qual o cloro pertence, necessitam de um elétron para completar a camada mais externa e atingir a configuração estável de um gás nobre, eles recebem um elétron facilmente e formam íons -1.
O sódio, ao perder um elétron, fica com uma camada contendo oito elétrons, assemelhando-se ao gás nobre neônio. O Cloro, ao receber um elétron, fica com a camada mais externa com oito elétrons também, assemelhando-se ao gás nobre argônio.
As cargas opostas dos dois íons resultam em atração eletrostática, fazendo com que uma rede cristalina lentamente comece a se formar. Essa rede cristalina é responsável por, entre outras coisas, manter a neutralidade elétrica da estrutura.
Na estrutura cristalina, cada átomo de sódio está rodeado por 6 átomos de cloro. Cada átomo de cloro está, por sua vez, rodeado por seis átomos de sódio. A proporção final de átomos de sódio para átomos de cloro é 6:6 que dá na mesma que 1:1. Por isso dizemos que a fórmula mínima do cristal é NaCl.
Em cristalografia, dizemos que o NaCl tem uma estrutura cristalina octaédrica.


|
S (g/kg) |
0 |
15 |
30 |
45 |
59 |
|
|
T (°C) |
0 |
−0.8 |
−1.7 |
−2.7 |
−3.6 |
|
|
S (g/kg) |
75 |
90 |
106 |
123 |
140 |
157 |
|
T (°C) |
−4.6 |
−5.5 |
−6.6 |
−7.8 |
−9.1 |
−10.4 |
|
S (g/kg) |
175 |
193 |
212 |
231 |
250 |
269 |
|
T (°C) |
−11.8 |
−13.2 |
−14.6 |
−16.2 |
−17.8 |
−19.4 |
|
S (g/kg) |
290 |
311 |
331 |
353 |
|
|
|
T (°C) |
−21.1 |
−17.3 |
−11.1 |
−2.7 |
|
|
A maior parte do sal vendido para consumo não é puro. Em 1911, carbonato de magnésio passou a ser adicionado ao sal de cozinha para fazê-lo fluir mais facilmente. Em 1924 quantidades-traço de iodeto de potássio (KI) passaram a ser adicionadas, a fim de reduzir a incidência de bócio (uma doença bem feia, nem vou colocar foto aqui).
Sal para descongelamento costuma conter hexacianoferrato de sódio (II) em concentrações menores que 100 ppm, a fim de permitir que o cloreto de sódio flua livremente para fora das caçambas que transportam o sal até a pista obstruída com neve, a despeito de ter permanecido armazenado longo tempo antes de ser usado.

(Você lembram daquele maldito saleiro de restaurante que passou a semana inteira em cima da mesa? Lembram quando tentaram colocar uma pitada de sal na salada e não conseguiram porque o sal estava grudado nos furos do saleiro? Pois é, por isso eles adicionam essa substância, para facilitar o trabalho de descarregar o sal).
Bom, e da próxima vez que perguntarem a vocês se são a favor ou contra a legalização do cloreto de sódio não vão precisar dar uma de intelectuais e ficar bolando explicações mirabolantes para evitar dizer que não conhecem essa substância.
Se vocês tiverem outras informações sobre o cloreto de sódio e quiserem compartilhar comigo, os comentários estão logo aí abaixo.
Ou podem me contatar pelo e-mail: contato@diariodeumquimicodigital.com
Até o próximo post!
A "molécula" de hoje é conhecida pelo nome lanolina, seu nome deriva do Latim: lana = lã e oleum = óleo.
Quer aprender mais? Então continue lendo esse post.
Ela também é chamada de Adeps Lanae, cera da lã, gordura da lã, gordura anidro da lã ou graxa da lã. É uma substância graxa amarela secretada pela glândulas sebáceas de diversos animais produtores de lã.
A maior parte da lanolina usada pelos humanos vem das criações domésticas de ovelhas. é quimicamente semelhante à cera, pode ser usada para proteger a pele ou simplesmente como agente impermeabilizante, e é às vezes usada em protetores labiais e em produtos para polimento de sapatos.
Nas ovelhas, a lanolina auxilia o animal a manter seu pelo livre de água. Certas raças de ovelha produzem grandes quantidades de lanolina, e a extração pode ser feita simplesmente espremendo a lã tosada entre rolos compressores. Normalmente, a lanolina é removida da lã quando ela é processada para a confecção de têxteis, tais como fios e feltros.
Um pouco de Química
Químicamente, a lanolina é uma cera, que é uma mistura de ésteres ou ácidos graxos com massa molecular elevada. Existem mais de 180 diferentes ácidos graxos e de 80 álcoois identificados na composição da lanolina.
Seu ponto de fusão está em torno de 40°C. Ela é insolúvel em água mas forma emulsões estáveis com ela.
Usos
Suas propriedades hidrofóbicas fazem-na um ingrediente valioso na fabricação de graxas lubrificantes onde a corrosão seria um problema, particularmente em aço inoxidável, o qual se torna menos vulnerável à corrosão quando protegido do oxigênio.
Lanolinas de grau médico são usadas na forma de creme para suavizar a pele, já que é hipoalergênica e bacteriostática. Nessa forma é usada por mães em fase de amamentação para aliviar dores nos mamilos e, também, para evitar rachaduras causadas pela amamentação.
Além disso, é usada no tratamento de lábios rachados, em assaduras de bebês, pele seca e com coceiras, calos, incisões menores, queimaduras leves e abrasões. Muitas variedades de cremes de barbear contém lanolina.
Como base de pomadas, é facilmente absorvida pela pele, facilitando a absorção de produtos químicos contidos na mistura. Alguns tradições médicas populares usam lanolina no nariz, em pequenas quantidades, para tratar resfriados.
No entanto, é necessário tomar cuidado ao usar lanolina impura, pois corre-se o risco de surgir uma bela reação alérgica em pessoas sensíveis.
A lanolina é usada, algumas vezes, como material de partida na produção de colecalciferol (vitamina D3).

(3β,5Z,7E)-9,10-secocolesta-5,7,10(19)-trien-3-ol (Vitamina D3)
A forma anidra é também usada como lubrificante de instrumentos musicais de sopro.
O uso de lanolina em vestes de lã torna-as impermeáveis à água, como em fraldas de pano, por exemplo.
Na produção de couro
Para proteger o couro do processo de degradação natural, pode-se tratá-lo com agentes de curtimento natural para criar um produto durável a partir de uma fonte orgânica.

A lanolina é um ingrediente largamente usado em "licores de gordura", os quais são aplicados após o curtimento a fim de amaciar o couro.
Esse processo agressivo filtra a maior parte dos lipídios animais que o couro necessita para permanecer macio e flexível. A umidade e o balanço natural de gorduras precisa ser restaurado após o curtimento para fazer com que o couro fique forte e resiliente.
Como um umidificante natural e protetor da pele, a natureza desenvolveu a cera da lã para amaciar e proteger a pele. Como resultado, a lanolina é amplamente usada como emoliente na indústria do couro.
A lanolina é também um ingrediente-chave no tratamento do couro e em produtos de limpeza (tais como sabões para lavagem de celas e arreios).
A lanolina é usada em produtos para:
- tratamento e processamento de couro curtido
- em óleos emolientes para tratamento de couro envelhecido
- em produtos para polimento de sapatos, como emulsificante e intensificador de brilho
- em produtos têxteis, como um emoliente que dá um acabamento suave.
Outros usos industriais
- Em tintas, pinturas e vernizes em spray:
- como agente dispersante, deixa a cobertura da tinta mais homogênea
- previne agregação e precipitação de pigmentos, pois melhora o manuseio das tintas
- como um agente de diminuição do tempo de secagem
- como um inibidor de penetração para tintas
- para conferir e controlar a fluidez.
- Em ceras de polimento e abrasivos:
- Como um condicionador e papel:
- melhorador de maciez do papel
- confere resistência a vapores a embalagens de instrumentos cirúrgicos que necessitam de esterilização
- Em cremes industriais de limpeza de mãos e em loções como um agente de super-engorduramento a fim de minimizar o efeito de desidratação dos detergentes.
- Em agentes de limpeza de óleo derramado (aqueles que costumam vazar de petroleiros no mar). Os sabões lanolínicos apresentam uma alta capacidade de ligar-se ao óleo derramado.
- Em produtos de concreto à prova d'água.
- Em numerosas outras aplicações, tais como colas para aviação, em ceras para cintos de transporte, graxas especiais, pastas para lubrificação de juntas e de vulcanização, etc.
Produção
A lanolina crua constitui aproximadamente 5-25% em peso da lã recém-tosqueada. A lã de uma ovelha pode produzir em torno de 250-350 mL de graxa recuperável. A lanolina é extraída por lavagem da lã com água quente com um detergente especial de lavagem para remoção da sujeira, da graxa da lã e dos sais produzidos pelo suor da ovelha. A graxa da lã é continuamente removida durante esse processo de lavagem por centrifugação, os quais concentram a graxa em uma substância de aparência cerosa que funde a aproximadamente 38°C.
E aí, você já se perguntou porque tem certas marcas de shampoo que ficam apregoando as maravilhas que o pantenol faz pelo seu cabelo?

Eu já, e é por isso que resolvi escrever esse "Molécula do dia" hoje.
Leia mais na continuação do post.
O pantenol, quimicamente conhecido pelo nome de d-pantenol, é um álcool. Ele é um precursor da vitamina B5, conhecida pelo nome de ácido pantotênico.
 (d-pantenol, prazer em conhecê-lo)
(d-pantenol, prazer em conhecê-lo)
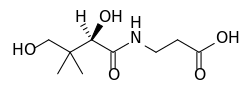 (Vitamina B5)
(Vitamina B5)
Como aprendemos em nossas aulas de Química Orgânica, a oxidação de um álcool primário leva a um ácido carboxílico. A aplicação do d-pantenol na pele ou nos cabelos faz com que ele seja absorvido e transformado em ácido pantotênico.
Por isso que o d-pantenol é chamado de pró-vitamina B5, porque ele realmente vira a tal vitamina. Além disso, a vitamina B5 está presente em todas as células vivas.
O d-pantenol é um co-fator enzimático importante, sendo um componente importante da Coenzima-A (CoA), a qual participa de reações de metabolismo intermediário de proteínas, carbohidratos e gorduras.
Achei o texto a seguir em um site especializado em cosméticos e beleza.
O ácido pantotênico é um constituinte natural da pele saudável. Sua presença é essencial para o funcionamento satisfatório do tecido epitelial. Pantenol, quando aplicado topicamente, penetra na pele e nas unhas, transformando-se em ácido pantotênico e regenerando as células epiteliais com rapidez. A deficiência do ácido pantotênico na pele conduz à cornificação, despigmentação e descamação.
Pesquisas têm demonstrado que 90% das pessoas vêem o ressecamento como o maior problema da pele. Durante o processo natural de envelhecimento da pele, esta vai perdendo sua capacidade de hidratar-se. Ocorre então a descamação, e a pele torna-se quebradiça e dura.
Pantenol, por sua capacidade de penetrar profundamente na pele e por sua propriedade umectante, atua como umidificante, aliviando o ressecamento causado pelo envehecimento natural da pele.Pantenol tem sido usado com sucesso por mais de 30 anos no tratamento de lesões de pele das mais variadas origens, desde fissuras nos mamilos até dermatites de contato, passando por dermatites solares.
Aplicado topicamente, Pantenol faz com que o novo epitélio formado seja de grande resistência, devido a uma estrutura mais compacta das camadas da epiderme.Pessoas expostas a intensa irradiação solar têm como conseqüência eritema, queimaduras, coceira, descamação, que podem resultar em pequenas cicatrizes e pigmentação irregular da pele. Pantenol tem propriedades de proteção contra o eritema e de aceleração do processo de cicatrização. Pantenol no cabelo...Pantenol, por ser uma molécula pequena, quando aplicada topicamente, penetra na raiz e no corpo do cabelo.
Pantenol produz um efeito condicionador, tornando o cabelo mais fácil de pentear, e mantendo sua aparência natural.Bonnet e Florens observaram que um tratamento com Pantenol resulta em:-Suspensão mais rápida da queda de cabelos;
-Retomada mais rápida do crescimento do cabelo;
-Cabelos mais fortes e espessos.Pantenol satisfaz as exigências de saúde e beleza dos cabelos (vida, elasticidade, volume, corpo, brilho, maciez, etc), além de controlar os fios rebeldes e facilitar o penteado.
Através da técnica de microscopia eletrônica mediu-se o efeito espessante do Pantenol sobre os cabelos e verificou-se que este espessa o cabelo em até 10% do seu diâmetro normal.
Através da mesma técnica de microscopia eletrônica também foi possível investigar as propriedades reparadoras do Pantenol. Os testes revelaram que a formação de pontas no corpo do fio de cabelo foi eliminada logo após o tratamento com uma solução aquosa de Pantenol.
Cabelos ressecados e danificados por tintura ou permanente não apresentam brilho e são difíceis de pentear. Pantenol penetra na raiz e nos fios de cabelo, formando uma camada elástica por dentro e por fora do fio.
Sendo assim, Pantenol retém ou absorve água do meio, proporcionando ao cabelo um efeito umectante, e recuperando rapidamente o seu brilho e corpo naturais.
Misturado à alantoína em concentrações de 2 a 5%, o d-pantenol pode ser usado para tratamento de queimaduras de pele causadas por exposição excessiva ao sol ou queimaduras leves causadas por outros agentes.
Ele promove a hidratação da pele, reduz as coceiras e inflamações, acelera a regeneração celular e, portanto, auxilia na cicatrização de feridas.
Quimicamente, ele atende por diversos nomes, alguns deles comercialmente registrados.
- N-(3-hidroxipropil)-3,3-dimetil-, (R)-
- Butiramida, 2,4-dihidroxi-N-(3-hidróxipropil)-3,3-dimetil-, D-(+)-
- Butanamida, 2,4-dihidroxi-N-(3-hidroxipropil)-3,3-dimetil-, (2R)-
- D-Pantenol
- Dexpantenol
- Dexpantenolum
- Propanolamina, N-pantoyl-
- álcool d-Pantotenílico
- Bepantene (esse eu uso após a troca de fraldas da minha filhota, e é do bom $$$)
Apresenta-se como um líquido altamente viscoso e transparente à temperatura ambiente, mas os sais do ácido pantotênico (por exemplo, pantotenato de sódio) são pós de cor branca (geralmente.
Ele é solúvel em água, álcool e propilenoglicol, também é solúvel em éter e clorofórmio, e ligeiramente solpuvel em glicerina.
Ele é sintetizado em duas formas enantioméricas, D e L. Apenas o enantiômero D é biologicamente ativo, entretanto ambas formas tem propriedades umidificantes.
Para uso cosmético, o pantenol vem na forma D, ou como uma mistura racêmica das formas D e L (DL-pantenol).
Então era isso, espero que tenham aprendido um pouco sobre essa fantástica molécula. E quando forem lavar seus cabelos com os maravilhosos shampoos tão elogiados pelo fabricante, podem levar a sério, a tal substância funciona.
Se você usar diariamente, pode ficar igualzinho à moça aí da foto (se você for homem, fuja desse shampoo, hehehehehe).

FONTE: Wikipedia



