
Flocos de neve e cristais de neve
Flocos de neve e cristais de neve são feitos de gelo, e praticamente nada mais. Um cristal de neve, como o nome indica, é um único cristal de gelo.
Um floco de neve é um termo mais genérico, que pode significar um cristal de neve individual,alguns cristais de neve presos juntos ou grandes aglomerações de cristais de neve que formam "puff-balls" que flutuam abaixo das nuvens.
A estrutura cristalina do gelo
As moléculas de água em um cristal de gelo formam uma rede cristalina hexagonal, como mostrado abaixo (as duas estruturas mostram diferentes visões do mesmo cristal).
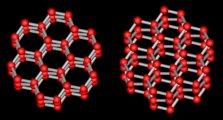
Flocos de neve não são gotas de chuva congelada. Às vezes, gotas de chuva se congelam enquanto caem, mas isso é chamado de granizo. Partículas de granizo não têm qualquer um dos elaborados padrões encontrados em cristais de neve simétricos. Os cristais de neve formam-se quando o vapor de água condensa diretamente em gelo, o que acontece nas nuvens. Os padrões emergem à medida que os cristais crescem.
Os flocos de neve mais simples
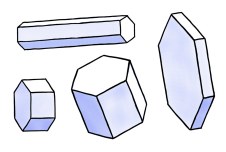
A forma mais básica de um cristal de neve é um prisma hexagonal, mostrado em vários exemplos abaixo.
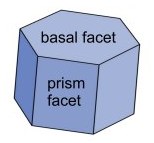
Um prisma hexagonal inclui duas faces hexagonais "basais" e seis faces "retangulares", como mostrado na figura acima.
Note que um prisma hexagonal pode ser colunar (alongado) ou achatado, dependendo da superfície facial crescer mais ou menos rapidamente.
Quando os cristais de neve são muito pequenos, eles são em forma de prisma hexagonal simples. Mas à medida que crescem, os ramos brotam dos cantos para produzir formas mais complexas.
O Diagrama de Morfologia
Ao crescer cristais de neve em laboratório sob condições controladas, verifica-se que suas formas dependem da temperatura e umidade. Esse comportamento é resumido no diagrama de morfologia (abaixo), o que dá a forma dos cristais em diferentes condições.
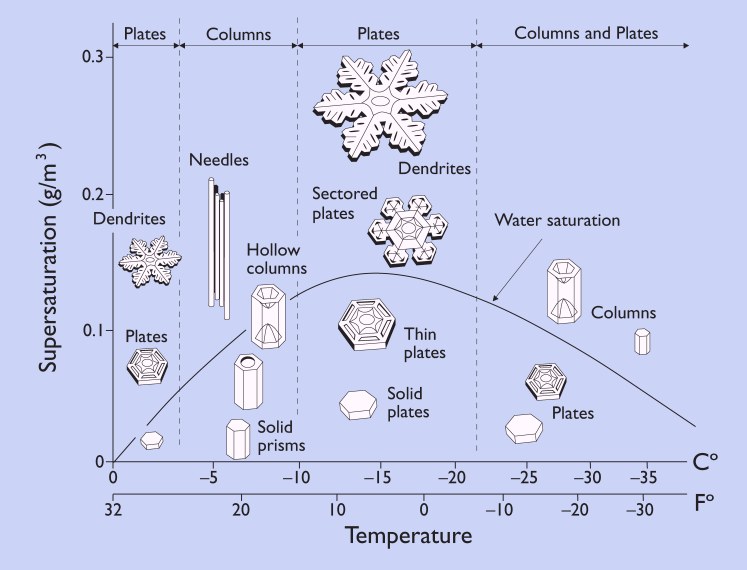
O diagrama de morfologia nos diz muito sobre o tipo de formação dos cristais de neve e em que condições.
Por exemplo, vemos que as chapas finas e as estrelas crescem em torno de -2°C (28°F), enquanto as colunas e agulhas finas aparecem próximo a -5°C (23°F). Placas e as estrelas formam novamente perto de -15°C (5°F), e uma combinação de placas e colunas acontece a cerca de -30°C (-22°F).
Além disso, vemos a partir do diagrama que os cristais de neve tendem a assumir formas mais simples quando a umidade (supersaturação) é baixa, enquanto formas mais complexas surgem em níveis de umidade mais elevados.
As formas mais extremas - agulhas longas e grandes a cerca de -5°C e placas finas em torno de -15°C - formam-se quando a umidade é especialmente elevada.
Por que formas de cristal de neve mudam tanto com a temperatura permanece um mistério científico. O crescimento depende exatamente como as moléculas de vapor de água são incorporadas no cristal de gelo em crescimento, e a física por trás disso é complexa e não é bem compreendida.
A vida de um floco de neve
A história de um floco de neve começa com vapor de água no ar. Evaporação de oceanos, lagos, rios colocam o vapor de água no ar, como faz a transpiração das plantas. Mesmo você, cada vez que expirar, coloca vapor de água no ar.
Quando você toma uma parcela de ar e a esfria, em algum ponto o vapor de água que fica preso começará a condensar. Quando isso acontece próximo ao solo, a água pode condensar-se como o orvalho sobre a relva. Acima do solo, vapor de água condensa em partículas de poeira no ar.
Ele condensa em inúmeras minúsculas gotículas, cada gota contém pelo menos uma partícula de poeira. A nuvem nada mais é que uma enorme coleção destas gotículas de água suspensas no ar.
No inverno, as nuvens formadoras de neve ainda são majoritariamente constituídas por gotículas de água líquida, mesmo quando a temperatura está abaixo de 0°C. A água está super-resfriada, o que significa simplesmente que é resfriado abaixo do ponto de congelamento.
À medida que as nuvens ficam mais frias, no entanto, as gotículas começam a congelar. Isso começa a acontecer em torno de -10ºC (14°F), mas é um processo gradual e as gotículas não congelam de uma vez.
Se uma gotícula em particular congela, torna-se uma pequena partícula de gelo, rodeada pelas restantes gotas de água líquida na nuvem.
O gelo cresce à medida que condensa o vapor de água em sua superfície, formando um floco de neve no processo. Como o gelo cresce, as gotas de água restantes evaporam lentamente e colocam mais vapor de água no ar.
Observe o que acontece com a água - ela evapora a partir das gotículas de água e vai para o ar, e ele sai do ar e se condensa em cristais de neve em crescimento. Enquanto a neve cai há um fluxo líquido de água do estado líquido (gotículas de água nas nuvens) para o estado sólido (flocos de neve). Esta cadeia de eventos um pouco complicada explica como uma nuvem congela.
Se quiserem saber mais sobre esse assunto, visitem o segundo link abaixo.


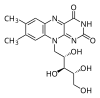



 (retinol, uma das diversas formas da vitamina A)
(retinol, uma das diversas formas da vitamina A)


 (ácido oléico)
(ácido oléico) (ácido linoleico)
(ácido linoleico) (ácido palmítico)
(ácido palmítico)

 (alfa-tocoferol ou vitamina E)
(alfa-tocoferol ou vitamina E) 
 (vitamina C, ácido L-ascórbico)
(vitamina C, ácido L-ascórbico)








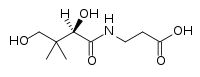
 (d-pantenol, prazer em conhecê-lo)
(d-pantenol, prazer em conhecê-lo)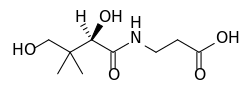 (Vitamina B5)
(Vitamina B5)





