Clicando no link a seguir AQUI, você vai acessar um simples applet java que simula um fluido (líquido, gás, sólido, depende da temperatura e pressão que você escolher) composto por discos macios.
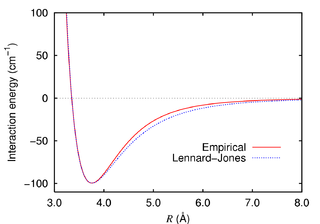
É como se a gente estivesse observando uma caixa contendo partículas atômicas (argônio, xenônio, etc) só que apenas em duas dimensões. Dá para usar esse programinha em uma aula de físico-química para ensinar sobre estados termodinâmicos da matéria apenas variando os valores das variáveis de estado (temperatura, densidade, pressão, número de átomos, etc). <Dr. Chatoff mode on>Apenas a título de informação, essa técnica de modelagem molecular é bem comum no meio acadêmico. Eu mesmo a conheço bem, visto que fiz doutorado em simulação de líquidos por dinâmica molecular. As partículas resumem-se a bolinhas que interagem umas com as outras por meio de potenciais aditivos aos pares, no caso desse applet usa-se o potencial de Lennard-Jones 12-6.![V(r) = 4\epsilon \left[ \left(\frac{\sigma}{r}\right)^{12} - \left(\frac{\sigma}{r}\right)^{6} \right],](http://upload.wikimedia.org/math/3/2/2/322cc39097022640ec80fb402803e4c0.png)
Na equação acima, o parâmetro ε representa toda a parte eletrônica e nuclear do átomo, é chamado de parâmetro energético, polarizabilidade ou simplesmente "profundidade do poço de potencial". O parâmetro σ representa a distância entre dois átomos do mesmo tipo na qual a energia potencial é zero. Representa o tamanho do átomo, tem valores grandes para átomos grandes (xenônio, por exemplo) e valores pequenos para átomos pequenos (hélio, por exemplo).
O parâmetro r representa a distância de separação entre os dois átomos. Se r for muito pequeno, o ramo de energia potencial repulsiva r−12 cresce absurdamente e as partículas tenderão a se repelir, se a distância r tornar-se muito grande, o ramo de energia potencial atrativa r−6 vai assumir maior valor e fazer com que as partículas voltem a se aproximar. Isso ajuda a representar as famosas forças de dispersão, conhecidas na Química como forças de Van der Waals.
Agora, voltando ao applet:


P.S.: Esqueci de colocar o link para o applet, mas agora já está corrigido. Divirtam-se.
 E não é um protótipo feioso e sem nenhuma apelo comercial, é um protótipo bem bonito e destinado a rodar pelas ruas das grandes cidades.Ele é capaz de desenvolver velocidades em torno de 50 milhas por hora, rodando apenas com hidrogênio e utilizando-se de uma rede de células de combustível para deixar os motores mais poderosos.Motores? Sim! Esse carrinho tem um motor para cada roda. E com apenas 2,2 libras de hidrogênio, ele é capaz de rodar até 240 milhas, tem capacidade para duas pessoas e é bem bonitinho.
E não é um protótipo feioso e sem nenhuma apelo comercial, é um protótipo bem bonito e destinado a rodar pelas ruas das grandes cidades.Ele é capaz de desenvolver velocidades em torno de 50 milhas por hora, rodando apenas com hidrogênio e utilizando-se de uma rede de células de combustível para deixar os motores mais poderosos.Motores? Sim! Esse carrinho tem um motor para cada roda. E com apenas 2,2 libras de hidrogênio, ele é capaz de rodar até 240 milhas, tem capacidade para duas pessoas e é bem bonitinho.