Vamos ver, 6 prótons sorridentes, 6 nêutrons simpáticos e 6 elétrons preocupados e apressados "girando" ao redor do núcleo.
Confere!
Um bom final-de-semana a todos!

Vamos ver, 6 prótons sorridentes, 6 nêutrons simpáticos e 6 elétrons preocupados e apressados "girando" ao redor do núcleo.
Confere!
Um bom final-de-semana a todos!






Coca-Cola e Mentos, simples assim!
<Dr. Chatoff mode on>
Na verdade, a brincadeira acima não é completamente desprovida de verdade.
Os extintores químicos de gás carbônico (CO2) funcionam por um princípio parecido.
A diferença reside no fato de haver bicarbonato (NaHCO3) no fundo do extintorm e ácido no topo dele (dentro de um recipiente aberto no topo).
Quando o extintor é virado de cabeça para baixo, o ácido se mistura ao bicarbonato e produz o dióxido de carbono segundo a reação abaixo:
2NaHCO3 + H2SO4 -> Na2SO4 + 2CO2 + 2H2O
E, voilá, o jato de CO2 encontra o fogo e nega justamente o que ele mais precisa para continuar, oxigênio.
Mas que ia ser bem mais divertido um extintor funcionar à base de mentos e coca.....
<Dr. chatoff mode off>
Resolvi tirar a preguiça do corpo e escrever um pouco mais sobre as descobertas que fundamentaram a ciência moderna.
Claro que eu vou continuar falando sem grandes pretensões, a minha ideia é informar sem esquecer o aspecto lúdico que a ciência pode ter. E, sempre que possível, vou lançar mão de recursos online para fazer isso.
O último post que escrevi fazia uma indagação: "Átomos são como pudins?"
Pelo menos foi a conclusão a que chegou o Sr. Thomson.
Agora, vamos conversar um pouco mais sobre os desenvolvimentos que levaram os cientistas ao modelo planetário.
Mais especificamente, vamos tratar da descoberta de Sir Ernest Rutherford e das implicações das teorias de Aage Niels Bohr no modelo atômico.


Rutherford realizou um experimento, hoje considerado clássico, no qual uma folha muito fina de ouro (tinha aproximadamente 100 átomos de espessura) era bombardeada com partículas alfa.
As partículas alfa são compostas por dois prótons e dois nêutrons, igual ao núcleo do elemento químico hélio só que sem os elétrons.
As partículas alfa são pesadas para os padrões atômicos, e ainda por cima possuem carga positiva igual a 2+.
Se as partículas alfa encontrarem prótons no seu caminho, que também possuem carga positiva, a repulsão eletrostática será tão grande que ela sofrerá um desvio na trajetória.
Foi o que Rutherford esperava observar, um grande número de partículas alfa desviando sua trajetória ao colidir com os átomos de ouro da folha que ele preparou.
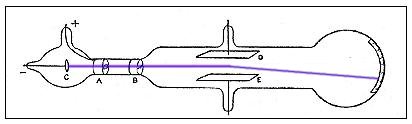
Uma representação esquemática do aparato preparado por Rutherford pode ser vista na figura abaixo:

A tela de detecção era sensibilizada com uma substância que brilhava a cada partícula alfa que a atingisse. Dizem que Rutherford colocou um aluno a observar a tal tela, ele tinha que contabilizar cada brilho que aparecesse nela.
Mais tarde, o tal aluno ficaria famoso por inventar um equipamento de detecção de radiação nuclear conhecido pelo nome de "contador Geiger".
O problema é que o átomo não era como Thomson havia proposto, ele não era composto de uma massa sólida de carga positiva com pequenas cargas negativas incrustadas na massa.
Isso porque, ao invés do que Rutherford observar a maior parte das partículas alfa sofrendo desvio, ele observou que a maioria delas passava direto pela folha de ouro.

Nas palavras dele: "(...) era como se bombardeássemos uma folha de papel com uma bala de canhão e a bala ricocheteasse na folha (...)".
Para que isso acontecesse, era necessário que o átomo fosse beeeem ao contrário do pudim de passas do Thomsom.
A maior parte da massa, de carga positiva, deveria estar concentrada em uma parte bem pequena e central dele. Rutherford chamou-a de núcleo.
A maior parte do volume do átomo deveria estar bem afastada do núcleo, ela deveria conter os elétrons. Rutherford chamou-a de eletrosfera.
O número de cargas positivas de um átomo eletricamente neutro deveria se igualar ao número de cargas negativas.
Estava estabelecido o modelo vigente de átomo, pelo menos a base dele.
E o Bohr, onde entra nessa história?

O modelo foi proposto por ele em 1913.
Basicamente, ele fez algumas suposições físico-matemáticas acerca dos elétrons em um átomo de hidrogênio:
Esse artigo da Wikipedia fala melhor sobre essa parte, sobre a qual falarei em um post futuro.
Para que um elétron pudesse girar em torno do núcleo atômico, ele deveria permanecer energeticamente estável. As leis da física vigentes na época previam que o elétron circulante deveria perder energia até colidir com o núcleo.
Bohr sugeriu as "órbitas estacionárias", nas quais os elétrons podiam permanecer indefinidamente.
Para subir a um nível mais energético, mais distante do núcleo, o elétron deveria receber um quantum energia.
Ao voltar ao nível menos energético, mais próximo do núcleo, o elétron deveria perder um quantum energia.
Assim, estavam estabelecidos os níveis ou camadas energéticas de um átomo, ou eletrosfera.
O modelo combinado é conhecido pelo nome dos dois cientistas: Rutherford-Bohr.
Devido ao fato de prever elétrons girando ao redor de um núcleo, a comparação com o sistema solar é inevitável e o modelo também é conhecido como "modelo planetário".
As equações matemáticas desenvolvidas por Bohr reproduziam exatamente o espectro de raias do Hidrogênio, tal como a equação de Rydberg o fazia.
O sucesso do modelo de Bohr em reproduzir dados experimentais fez com que a representação mais comum do átomo seja usada até hoje, embora esteja incorreta segundo as teorias quânticas mais modernas.

Por hoje era isso, tomara que me sobre um tempo nos próximos meses para continuar com essa série de posts. :)
FONTES: Royal Society of Chemistry, Wikipedia

Ligações covalentes simples são formadas quando dois átomos compartilham uma aresta, como na estrutura C abaixo. Isso resulta na troca de dois elétrons. Ligações iônicas são formadas pela transferência de um elétron de um cubo para outro, sem compartilhar uma aresta (A). Um estado intermediário B, onde apenas um canto é compartilhado também foi postulada por Lewis.
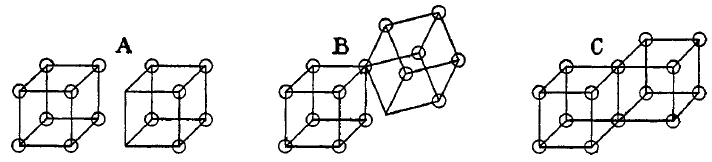
Ligações duplas são formadas pelo compartilhamento de uma face entre dois átomos cúbicos. Isto resulta no compartilhamento de quatro elétrons:
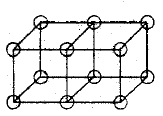
Ligações triplas não podiam ser explicadas pelo modelo do átomo cúbico, porque não há nenhuma maneira de dois cubos compartilharem três cantos.
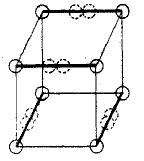
Lewis sugeriu que os pares de elétrons em ligações atômicas têm uma atração especial, o que resulta em uma estrutura tetraédrica, como npróxima figura (a nova localização dos elétrons é representado pelos círculos pontilhados no meio das bordas grossas).
Isto permite a formação de um vínculo único, através da partilha de um vértice, uma ligação dupla, compartilhando uma aresta e uma tripla ligação através da partilha de uma face do cubo.
Ele também reproduz a rotação livre em torno de ligações simples e também a geometria tetraédrica do metano.
Extraordinariamente, pode-se dizer que havia um grão de verdade nesta ideia, porque mais tarde foi mostrado que os resultados do princípio da exclusão de Pauli resultam em um "buraco de Fermi" cuja repulsão decresce entre um par de elétrons com spins opostos no mesmo orbital.
Como essa teoria teve o mérito de explicar a ligação covalente sem recorrer a conceitos complicados da mecânica quântica, foi logo aceito e é ensinado até hoje nas escolas. O problema é que ele falha em explicar compostos de Boro e/ou compostos que aceitam mais do que 8 elétrons na camada de valência.
Isso faz com que muitos professores, apegados ao que eles chamam "regra do octeto", preferem esconder as exceções para não estragar a beleza da tal regra. Só que ela não é uma lei, é uma regra, baseada em uma teoria parcialmente bem sucedida. Não podemos negar a elegância da proposição de Lewis, mas também não podemos atribuir-lhe um caráter de infalibilidade.
Ensinem a teoria de Lewis, mas evitem usar esse termo "regra do octeto", e familiarizem-se com a história da ciência que vocês (eu inclusive) se dedicam a ensinar para evitar de propagar conceitos errôneos.
Para os mais curiosos, o artigo original de Lewis foi publicado aqui:
01/04/1916. "THE ATOM AND THE MOLECULE.
Journal of the American Chemical Society 38 (4): 762–785.
doi:10.1021/ja02261a002
FONTES: Wikipedia1, Wikipedia2, História da Química - Um livro-texto para a graduação
Hoje é o dia da Terra, ou Earth Day para os íntimos.

Lá no site http://www.earthday.org/ você pode acompanhar toda a movimentação mundial em prol do planeta em todos os lugares em que vai acontecer alguma atividade pública,
E já que o tema de hoje é esse, vamos puxar a brasa para o meu assado que é a físico-química.
Li um artigo bem interessante nesse site aqui ó LINK. O autor fala sobre o fenômeno da tensão superficial. E o que isso tem a ver com o dia da Terra?
Acompanhem o raciocínio comigo:

Moléculas no interior do líquido (água, no caso) apresentam isotropia (ou quase isso) de forças. Em palavras de seres humanos normais, as forças de atração intermoleculares são igualmente distribuídas pelo espaço.
Já as moléculas na superfície do líquido conseguem interagir apenas com moléculas ao lado e abaixo de si, porém interagem muito pouco com outras moléculas acima de si, visto que são raras as moléculas presentes na fase gasosa.
Se você observar bem a figura acima, notará que ocorre um desequilíbrio de forças nas moléculas da superfície, fazendo com que a força resultante seja direcionada para o interior do líquido.

O resultado disso? Forma-se um filme superficial de liquido, uma película. Ela é bem forte, pode suportar o peso de um pequeno inseto sobre ela, às vezes até mesmo um clip de papel pode ser colocado com cuidado sobre o filme superficial sem que ele se rompa.
A tensão superficial é responsável pelos líquidos formarem gotas esféricas, o que determina se o líquido vai ou não molhar uma superfície tem relação também com a tensão superficial. A água, por exemplo, vai espalhar-se bem em superfícies polares, e vai tender a formar gotículas quase-esféricas em superfícies apolares.
A adição de um surfactante (vamos dizer, por exemplo, um detergente líquido) à água faz com que o filme superficial perca coesão. Como resultado disso, a água torna-se mais "molhada", ela se espalha mais do que sem a presença do detergente.
Isso é bem útil quando queremos que a água dissolva uma superfície gordurosa (como aquelas que ficam sobre os pratos que usamos em nossa alimentação). O detergente dissolve a gordura do prato e a água ajuda a carregar a sujeira removida pelo detergente.
Justamente essa tecnologia que nos ajuda a manter nossos utensílios de alimentação limpos é a causa de muita preocupação por parte das pessoas preocupadas com o ambiente terrestre.
O uso indiscriminado de detergentes semi-biodegradáveis faz com que a tensão superficial das águas diminua consideravelmente.
O despejo de nossos resíduos domésticos nos rios e lagos faz com que a água não seja mais um ambiente propício aos pequenos insetos, visto que eles não conseguem mais caminhar sobre o filme superficial com tanta facilidade.
Isso faz com que a reprodução desses pequenos seres seja ameaçada, gerando um desequilíbrio ecológico sem precedentes.
Além disso, certas substâncias presentes nas embalagens plásticas são despejadas nos mesmos rios e lagos e afetam negativamente os ciclos hormonais de pequenos anfíbios e mamíferos que bebem ou vivem nessas águas contaminadas.
Vejam, não quero alarmar ninguém com essa reflexão, mas no dia dedicado ao nosso planeta, nada melhor do que falar abertamente de um problema que certamente não vai parar de cresces enquanto continuarmos a usar indiscriminadamente produtos de limpeza pouco ecológicos.
Uma solução paliativa seria passar a usar o sabão em barra para lavar as louças, ele é menos efetivo que o detergente líquido mas é completamente biodegradável e afetaria em menor escala as águas.
Bom, vou parar de filosofar por aqui, desejo um dia de profundas reflexões a todos os terrestres (e se tiver algum leitor marciano que acessa o blog também sugiro que leia o texto todo e use nas suas salas de aula marcianas).
Abraços digitais!
GAUTO, Marcelo;
; acessado dia 13/04/2010.


Os íons cromato (CrO
2CrO42-(aq) + Hg(l) +16H+(aq) + 3SO42-(aq) à 2Cr3+(aq) + HgSO4(s) + 8H2O(l)
Quando o ferro encosta na parte positiva do mercúrio, ocorre uma transferência de elétrons do ferro para o mercúrio, reduzindo-o a mercúrio ”zero”, através da seguinte reação:
Fe(s) + HgSO4(s) à Fe2+(aq) + SO42-(aq) + Hg(l)
Esta transferência de elétrons causa outra mudança na tensão superficial do mercúrio, fazendo com que ele fique mais coeso, o que leva o mercúrio a se afastar do ferro levando a uma nova oxidação, achatando a gota mais uma vez e permitindo que a gota encoste novamente no ferro gerando um ciclo repetitivo.