
Ligações no modelo cúbico de átomo
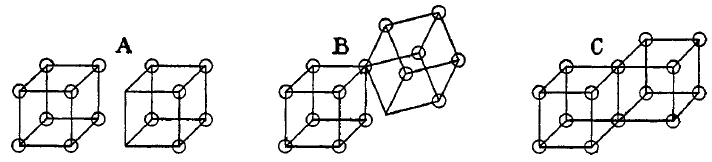
Ligações covalentes simples são formadas quando dois átomos compartilham uma aresta, como na estrutura C abaixo. Isso resulta na troca de dois elétrons. Ligações iônicas são formadas pela transferência de um elétron de um cubo para outro, sem compartilhar uma aresta (A). Um estado intermediário B, onde apenas um canto é compartilhado também foi postulada por Lewis.
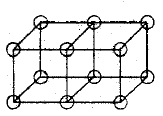
Ligações duplas são formadas pelo compartilhamento de uma face entre dois átomos cúbicos. Isto resulta no compartilhamento de quatro elétrons:
Ligações triplas não podiam ser explicadas pelo modelo do átomo cúbico, porque não há nenhuma maneira de dois cubos compartilharem três cantos.
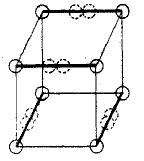
Lewis sugeriu que os pares de elétrons em ligações atômicas têm uma atração especial, o que resulta em uma estrutura tetraédrica, como npróxima figura (a nova localização dos elétrons é representado pelos círculos pontilhados no meio das bordas grossas).
Isto permite a formação de um vínculo único, através da partilha de um vértice, uma ligação dupla, compartilhando uma aresta e uma tripla ligação através da partilha de uma face do cubo.
Ele também reproduz a rotação livre em torno de ligações simples e também a geometria tetraédrica do metano.
Extraordinariamente, pode-se dizer que havia um grão de verdade nesta ideia, porque mais tarde foi mostrado que os resultados do princípio da exclusão de Pauli resultam em um "buraco de Fermi" cuja repulsão decresce entre um par de elétrons com spins opostos no mesmo orbital.
Como essa teoria teve o mérito de explicar a ligação covalente sem recorrer a conceitos complicados da mecânica quântica, foi logo aceito e é ensinado até hoje nas escolas. O problema é que ele falha em explicar compostos de Boro e/ou compostos que aceitam mais do que 8 elétrons na camada de valência.
Isso faz com que muitos professores, apegados ao que eles chamam "regra do octeto", preferem esconder as exceções para não estragar a beleza da tal regra. Só que ela não é uma lei, é uma regra, baseada em uma teoria parcialmente bem sucedida. Não podemos negar a elegância da proposição de Lewis, mas também não podemos atribuir-lhe um caráter de infalibilidade.
Ensinem a teoria de Lewis, mas evitem usar esse termo "regra do octeto", e familiarizem-se com a história da ciência que vocês (eu inclusive) se dedicam a ensinar para evitar de propagar conceitos errôneos.
Para os mais curiosos, o artigo original de Lewis foi publicado aqui:
01/04/1916. "THE ATOM AND THE MOLECULE.
Journal of the American Chemical Society 38 (4): 762–785.
doi:10.1021/ja02261a002
FONTES: Wikipedia1, Wikipedia2, História da Química - Um livro-texto para a graduação